
La photocatalyse est l’une des variantes des processus d’oxydation avancée (POA), qui sont particulièrement intéressants pour le traitement de l’eau et de l’air en raison de leur efficacité à neutraliser une grande variété de polluants grâce à la génération de radicaux hydroxyles hautement réactifs. Parmi les POA, la photocatalyse, principalement celle utilisant le dioxyde de titane (TiO2) comme photocatalyseur, a été largement étudiée ces dernières années. Cette nouvelle technologie est aujourd’hui considérée comme un concurrent des techniques de purification classiques. Pour cette raison, on trouve de plus en plus d’études scientifiques et de brevets dans la littérature.
Bien qu’à l’origine des photocatalyseurs de TiO2 aient été utilisés pour le traitement de l’eau, ces dernières années, il a été constaté que l’oxydation photocatalytique des composés organiques volatils (COV) est généralement plus efficace en phase gazeuse qu’en phase liquide.
Dernièrement, le nombre de brevets pour le traitement de l’air dépasse celui de tous les brevets pour le traitement de l’eau et des surfaces autonettoyantes. Cela démontre l’intérêt réel de la communauté industrielle pour les applications de nettoyage de l’air.
Les origines de la photocatalyse
Le premier rapport publié sur la fotoréactivité a été élaboré par Renz en 1921. Cependant, le premier titre faisant référence au terme « photocatalyse » n’a été publié qu’en 1964, dans un article de Hauffe dans le Journal of Catalysis. Selon Teichner et al. [1], il est intéressant de souligner que le concept et le terme « photocatalyse hétérogène » ont été introduits et développés à Lyon en 1972, où des solutions photocatalytiques possibles à divers problèmes environnementaux utilisant le TiO2 ont également été proposées.
Initialement, P. Pichat et J. M. Herrmann ont étendu les premières études sur la photocatalyse hétérogène de Lyon à des applications environnementales et contre la pollution à l’Institut de Recherche sur la Catalyse (IRC). En 1999, la publication de « Photocatalyse hétérogène : fondamentaux et applications dans l’élimination de divers types de polluants aqueux », de J.M. Herrmann, a remporté un prix pour être l’un des 10 articles les plus cités cette année-là dans Catalysis Today [2].
Photocatalyse médiée par TiO2
Parmi les semi-conducteurs disponibles pouvant être utilisés comme photocatalyseurs, le TiO2 est généralement considéré comme le meilleur photocatalyseur disponible aujourd’hui. Une écrasante majorité de la littérature concernant la photocatalyse se concentre sur l’identification des propriétés, des applications et de la théorie d’utilisation du dioxyde de titane en tant que semi-conducteur. Il y a de bonnes raisons pour que le TiO2 soit le semi-conducteur préféré, telles que :
- Il a un grand potentiel d’oxydation à température et pression ambiantes.
- Il montre une grande activité photocatalytique pour dégrader une large gamme de polluants environnementaux.
- Il est chimiquement inerte.
- Il est physiquement stable.
- Il n’est pas toxique.
- Il est superhydrophile.
- Il est économique et facilement accessible.
Il existe déjà plusieurs produits commerciaux de TiO2 photocatalytique disponibles sur le marché ; en particulier le TiO2 Degussa P25, qui est souvent considéré comme une norme et est fréquemment utilisé comme élément de comparaison dans l’expérimentation scientifique pour déterminer l’activité photocatalytique.
Qu’est-ce qu’un semi-conducteur ?
Les matériaux semi-conducteurs se caractérisent par leur structure électronique, qui peut être décrite par la théorie des bandes des matériaux [3]. La théorie des bandes établit que tous les matériaux ont des niveaux électroniques possibles, définis comme des bandes. Les matériaux sont classés selon la séparation énergétique qui existe entre ces bandes, également connue sous le nom de bande interdite. La figure 1 illustre schématiquement les différences dans la structure électronique d’un isolant (bande interdite très grande), d’un semi-conducteur (bande interdite plus petite) et d’un métal (sans bande interdite, avec une continuité des états électroniques à travers le matériau). Selon la théorie des bandes, la bande de valence correspondrait aux niveaux d’énergie occupés, tandis que la bande de conduction serait constituée par les états électroniques disponibles vacants jusqu’à ce que le matériau soit excité thermiquement ou électroniquement.
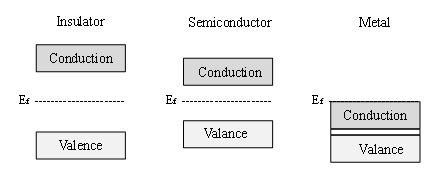 Figure 1. Diagramme schématique de la structure des bandes d’un isolant, d’un semi-conducteur et d’un métal.
Figure 1. Diagramme schématique de la structure des bandes d’un isolant, d’un semi-conducteur et d’un métal.
Photoexcitation du TiO2
La Figure 2 illustre la formation d’une paire électron-trou dans la photocatalyse du TiO2. Les électrons de valence responsables de maintenir ensemble les atomes occupent normalement la bande de valence. Les électrons responsables des propriétés électroconductrices occupent la bande de conduction. Entre les deux bandes se trouve la bande interdite ou la bande de séparation énergétique. Cette région est inoccupée, car les électrons ne peuvent pas avoir la valeur énergétique correspondant au niveau interdit. Un conducteur a suffisamment d’électrons pour occuper également la bande de conduction, tandis que, dans un isolant, la bande de conduction est essentiellement vide. Le dioxyde de titane (TiO2) est un semi-conducteur, ce qui signifie qu’il a une bande interdite plus étroite (3,2 eV pour l’anatase et 3,0 eV pour le rutile) que les isolants. La bande de conduction devient accessible aux électrons de la bande de valence lorsqu’il y a suffisamment d’énergie pour l’excitation. Cette énergie permet aux électrons de « sauter » à travers la bande interdite. Le processus d’excitation de l’électron laisse derrière lui une charge positive ou un trou dans la bande de valence. La photocatalyse médiée par le semi-conducteur est déclenchée par la capacité de cette paire électron-trou à initier une réaction catalytique.
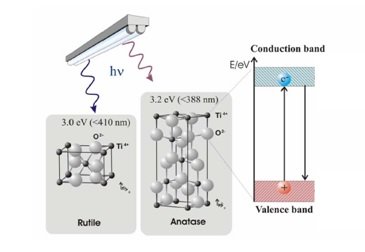 Figure 2. Formation de la paire électron-trou dans le TiO2 (rutile – anatase).
Figure 2. Formation de la paire électron-trou dans le TiO2 (rutile – anatase).
Mécanisme général de la réaction photocatalytique
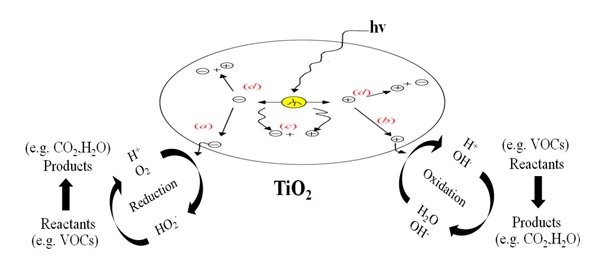 Figure 3. Processus général de la photocatalyse du TiO2.
Figure 3. Processus général de la photocatalyse du TiO2.
(a) L’électron de la bande de conduction qui migre avec succès vers la surface initie la réaction de réduction.
(b) Le trou de la bande de valence qui migre vers la surface initie le processus oxydatif.
(c) Le trou de la bande et l’électron de la bande de conduction se recombinent dans le matériau brut.
(d) Le trou de la bande et l’électron de la bande de conduction se recombinent à la surface.
Traitement de l’air par oxydation photocatalytique (OFC)
L’OFC dans la purification de l’air implique un gaz chargé de polluants et un photocatalyseur, généralement sous forme immobilisée. Voici un résumé des avantages du traitement photocatalytique de l’air :
- Génération facile de la photocatalyse.
- Taux de réaction plus élevé par rapport à la photocatalyse liquide.
- Capacité d’oxyder de faibles concentrations et des courants de déchets à faible débit à des températures et pressions ambiantes ou différentes.
- Les réactions en phase gazeuse permettent l’application directe des outils analytiques pour surveiller la composition, la structure et l’état électronique du substrat et des adsorbats ; ainsi, les mécanismes de réaction peuvent être élucidés directement.
- Les réacteurs photocatalytiques peuvent être intégrés dans des systèmes de chauffage, ventilation ou climatisation (CVC), nouveaux ou préexistants, grâce à leur conception modulaire, leur fonctionnement à température ambiante et leur chute de pression négligeable. De plus, ils peuvent être dimensionnés pour s’adapter à une large variété d’applications de qualité de l’air.
- Utilisation potentielle de l’énergie solaire.
Le tableau 1 résume les études sur la photocatalyse avec TiO2 pour le traitement de l’air avec différents groupes de polluants organiques. Le tableau montre que les différents groupes de produits chimiques présentent un comportement différent, unique à chaque groupe.
Tableau 1. OFC dans la purification de l’air
Paramètres influençant le processus photocatalytique
Un processus photocatalytique typique est très complexe, avec de nombreux facteurs affectant l’efficacité photocatalytique. Il est possible de faire une distinction entre les paramètres intrinsèques et extrinsèques. Les paramètres intrinsèques sont ceux liés aux propriétés du photocatalyseur lui-même (physiques et chimiques). Les paramètres extrinsèques sont des facteurs externes, tels que les conditions d’opération. Voici quelques-uns de ces paramètres.
- Concentration d’entrée du polluant.
- Température.
- Sources de lumière (UV-Solaire).
- Support et charge de la catalyse.
Désactivation et régénération du photocatalyseur
La désactivation du photocatalyseur se produit lorsque l’on observe une diminution progressive du taux de conversion lors d’expérimentations prolongées avec des conditions invariables. La perte d’activité photocatalytique du catalyseur peut être considérée comme réversible ou irréversible. En général, la désactivation sera irréversible s’il y a absorption chimique et réversible lorsque l’absorption est physique. La désactivation peut être provoquée par l’absorption et l’accumulation de sous-produits fortement liés à la surface, qui bloquent les sites actifs du photocatalyseur.
Un photocatalyseur peut être régénéré partiellement ou complètement en purgeant le système avec un ou plusieurs des éléments suivants :
- Seulement de l’eau.
- Air pur sous éclairage.
- Air humide avec ou sans éclairage.
- Air avec H2O2, avec ou sans éclairage.
- Air avec O3, avec ou sans éclairage.
- Air pur sous éclairage à température élevée.
Conclusions
Bien qu’un grand travail ait été réalisé sur la photocatalyse pour le traitement de l’air, l’effet environnemental de l’OFC n’est pas encore complètement compris. En général, dans la littérature, le rendement photocatalytique est évalué en fonction de la conversion du polluant cible et de l’influence des différents paramètres opérationnels. Il y a peu d’informations sur la nature et le type de sous-produits produits et aucune sur la minéralisation du CO2. Ces informations sont essentielles pour comprendre le processus et pour développer avec succès des applications photocatalytiques commerciales. La Figure 4 montre les connaissances actuelles sur l’application de la technologie de l’OFC pour résoudre les problèmes de pollution de l’air.
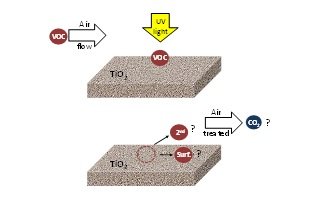 Figure 4. COV agissant sur le TiO2 irradié : formation de polluants secondaires (2nd) réémis dans l’air traité, espèces de l’oxydation liées à la surface (surf) et formation de CO2.
Figure 4. COV agissant sur le TiO2 irradié : formation de polluants secondaires (2nd) réémis dans l’air traité, espèces de l’oxydation liées à la surface (surf) et formation de CO2.
Bibliographie
[1] Teichner, S., Les origines de la photocatalyse. Journal of Porous Materials, 2008. 15(3): p. 311-314.
[2] Herrmann, J.-M., Photocatalyse hétérogène : fondamentaux et applications dans l’élimination de divers types de polluants aqueux. Catalysis Today, 1999. 53(1): p. 115-129.
[3] Mills, A. et S. Le Hunte, Un aperçu de la photocatalyse des semi-conducteurs. Journal of Photochemistry and Photobiology A: Chemistry, 1997. 108(1): p. 1-35.