La fotocatálisis es una de las variantes de los procesos de oxidación avanzada (PAO), que son particularmente interesantes para el tratamiento del agua y el aire debido a su eficiencia al neutralizar una gran variedad de contaminantes gracias a la generación de radicales hidroxílicos altamente reactivos. Entre los PAO, la fotocatálisis, principalmente la que usa dióxido de titanio (TiO2) como fotocatalizador, se ha estudiado ampliamente en los últimos años. Esta nueva tecnología es considerada hoy en día como un competidor de las técnicas de purificación clásicas. Por esto, cada vez se pueden encontrar en la literatura más estudios científicos y patentes.
Aunque en un primer momento se usaban fotocatalizadores de TiO2 para el tratamiento del agua, en los últimos años se ha visto que la oxidación fotocatalítica de compuestos orgánicos volátiles (COV) es generalmente más eficiente en la fase gaseosa que en la fase líquida.
Últimamente, el número de patentes de tratamiento de aire supera al de todas las patentes de tratamiento de agua y de superficies autolimpiables. Esto demuestra el interés real que muestra la comunidad industrial en las aplicaciones de limpieza de aire.
Los orígenes de la fotocatálisis
El primer informe publicado sobre la fotorreactividad fue elaborado por Renz en 1921. Sin embargo, el primer título que hacía referencia al término «foto-catálisis» no se publicó hasta 1964, en un artículo de Hauffe en el Journal of Catalysis. De acuerdo con Teichner et al. [1], es interesante destacar que el concepto y el término «fotocatálisis heterogénea» se introdujo y desarrolló en Lyon en 1972, donde también se propusieron posibles soluciones fotocatalíticas a varios problemas medioambientales usando TiO2.
Inicialmente, P. Pichat y J. M. Herrmann extendieron los primeros estudios sobre la fotocatálisis heterogénea de Lyon a aplicaciones medioambientales y contra la contaminación en el Instituto de Investigación sobre la Catálisis (IRC). En 1999, la publicación de «Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants», de J.M. Herrman, ganó un premio por ser uno de los 10 artículos más citados ese año en Catalysis Today [2].
Fotocatálisis mediada por TiO2
De entre los semiconductores disponibles que se pueden usar como fotocatalizadores, el TiO2 es considerado normalmente el mejor fotocatalizador disponible hoy en día. Una abrumarte mayoría de la literatura referente a la fotocatálisis se centra en identificar las propiedades, aplicaciones y teoría de uso del dióxido de titanio como semiconductor. Hay buenas razones para que el TiO2 sea el semiconductor preferido, como por ejemplo:
- Tiene un gran potencial de oxidación a temperatura y presión ambiente.
- Muestra una gran actividad fotocatalítica para degradar una amplia gama de contaminantes medioambientales.
- Es químicamente inerte.
- Es físicamente estable.
- No es tóxico.
- Es superhidrofilico.
- Es económico y fácilmente accesible.
Ya hay varios productos comerciales de TiO2 fotocatalítico disponibles en el mercado; en particular Degussa P25 TiO2, que en muchos aspectos se considera un estándar y se utiliza a menudo como elemento de comparación en la experimentación científica para determinar la actividad fotocatalítica.
¿Qué es un semiconductor?
Los materiales semiconductores se caracterizan por su estructura electrónica, que se puede describir con la teoría de bandas de los materiales [3]. La teoría de bandas establece que todos los materiales tienen unos niveles electrónicos posibles, definidos como bandas. Los materiales se clasifican según la separación energética que existe entre dichas bandas, también conocida como la banda prohibida. La figura 1 ilustra esquemáticamente las diferencias en la estructura electrónica de un aislante (banda prohibida muy grande), un semiconductor (banda prohibida menor) y un metal (sin banda prohibida, con una continuidad de los estados electrónicos por todo el material). De acuerdo con la teoría de bandas, la banda de valencia correspondería a los niveles de energía ocupados, mientras que la banda de conducción estaría constituida por los estados electrónicos disponibles vacantes hasta que el material se excita térmica o electrónicamente.
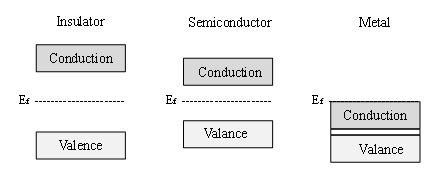
Fotoexcitación del TiO2
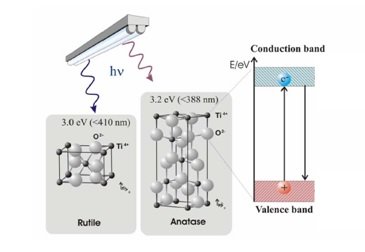
En la Figura 2 se ilustra la formación de un par electrón-hueco en la fotocatálisis del TiO2. Los electrones de valencia responsables de mantener juntos los átomos ocupan normalmente la banda de valencia. Los electrones responsables de las propiedades electroconductoras ocupan la banda de conducción. Entre las dos bandas se encuentra la banda prohibida o brecha energética. Esta región está sin ocupar, puesto que los electrones no pueden tener el valor energético correspondiente al nivel prohibido. Un conductor tiene suficientes electrones para ocupar también la banda de conducción, mientras que, en un aislante, la banda de conducción está esencialmente vacía. El dióxido de titanio (TiO2) es un semiconductor, lo que significa que tiene una banda prohibida más estrecha (3,2 eV para anatasa y 3,0 eV para rutilo) que los aislantes. La banda de conducción se hace accesible a los electrones de la banda de valencia cuando hay suficiente energía para la excitación. Esta energía permite a los electrones «saltar» a través de la banda prohibida. El proceso de excitación del electrón deja detrás una carga positiva o hueco en la banda de valencia. La fotocatálisis mediada por el semiconductor se dispara por la capacidad de este par electrón-hueco de iniciar una reacción catalítica.
Mecanismo general de la reacción fotocatalítica
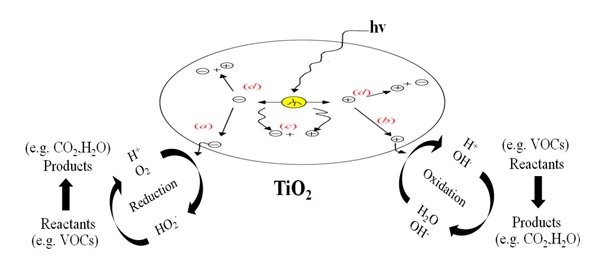
(a) El electrón de la banda de conducción que migra con éxito a la superficie inicia la reacción de reducción.
(b) El hueco de la banda de valencia que migra a la superficie inicia el proceso oxidativo.
(c) El hueco de la banda y el electrón de la banda de conducción se recombinan en el material en bruto.
(d) El hueco de la banda y el electrón de la banda de conducción se recombinan en la superficie.
Tratamiento del aire por oxidación fotocatalítica (OFC)
La OFC en la purificación del aire implica un gas cargado de contaminantes y un fotocatalizador, normalmente en formas inmovilizadas. A continuación, hay un resumen de las ventajas del tratamiento fotocatalítico del aire:
- Fácil generación de la fotocatálisis.
- Mayor tasa de reacción en comparación con la fotocatálisis líquida.
- Capacidad de oxidar bajas concentraciones y corrientes de residuos de bajo caudal a temperaturas y presiones ambientales o distintas.
- Las reacciones de fase gaseosa permiten la aplicación directa de las herramientas analíticas para monitorizar la composición, estructura y estado electrónico del substrato y los adsorbatos; por lo que los mecanismos de reacción pueden elucidarse directamente.
- Los reactores fotocatalíticos pueden integrarse en sistemas de calefacción, ventilación o aire acondicionado (HVAC), nuevos o preexistentes, gracias a su diseño modular, su funcionamiento a temperatura ambiente y su despreciable caída de presión. Además, se pueden escalar para adecuarlos a una amplia variedad de aplicaciones de calidad del aire.
- Utilización potencial de energía solar.
La tabla 1 resume los estudios sobre la fotocatálisis con TiO2 para el tratamiento del aire con distintos grupos de contaminantes orgánicos. La tabla muestra que los distintos grupos de productos químicos muestran un comportamiento diferente, único de cada grupo.
Tabla 1. OFC en la purificación del aire
Parámetros que influyen en el proceso fotocatalítico
Un proceso fotocatalítico típico es muy complejo, con muchos factores que afectan a la eficiencia fotocatalítica. Es posible hacer una distinción entre los parámetros intrínsecos y los extrínsecos. Los parámetros intrínsecos son los relacionados con las propiedades del propio fotocatalizador (físicas y químicas). Los parámetros extrínsecos son factores externos, como las condiciones de operación. A continuación, se discuten algunos de estos parámetros.
- Concentración de entrada del contaminante.
- Temperatura.
- Fuentes de luz (UV-Solar).
- Soporte y carga de la catálisis.
Desactivación y regeneración del fotocatalizador
La desactivación del fotocatalizador sucede cuando se observa una disminución gradual de la tasa de conversión en experimentación prolongada con condiciones invariables. La pérdida de actividad fotocatalítica de catalizador se puede considerar reversible o irreversible. En general, la desactivación será irreversible si hay absorción química y reversible cuando la absorción sea física. La desactivación puede estar provocada por la absorción y acumulación de subproductos fuertemente unidos en la superficie, que bloquean los puntos activos del fotocatalizador.
Un fotocatalizador puede regenerarse parcial o completamente purgando el sistema con uno o más de los siguientes elementos:
- Solo agua.
- Aire puro bajo iluminación.
- Aire húmedo con o sin iluminación.
- Aire con H2O2, con o sin iluminación.
- Aire con O3, con o sin iluminación.
- Aire puro bajo iluminación a temperatura elevada.
Conclusiones
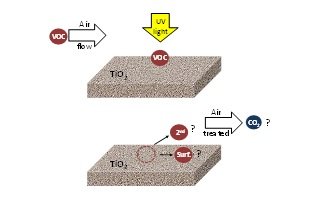
A pesar de que se ha hecho un gran trabajo en la fotocatálisis para el tratamiento del aire, el efecto medioambiental de la OFC todavía no se comprende del todo. Por lo general, en la literatura, el rendimiento fotocatalítico se evalúa en función de la conversión del contaminante objetivo y la influencia de los distintos parámetros operativos. Hay poca información sobre la naturaleza y tipo de subproductos producidos y ninguna sobre la mineralización del CO2. Esta información es esencial para entender el proceso y para desarrollar con éxito aplicaciones fotocatalíticas comerciales. La Figura 4 muestra el conocimiento actual en la aplicación de la tecnología de OFC para solucionar los problemas de contaminación aérea.
Bibliografía
[1] Teichner, S., The origins of photocatalysis. Journal of Porous Materials, 2008. 15(3): p. 311-314.
[2] Herrmann, J.-M., Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants. Catalysis Today, 1999. 53(1): p. 115-129.
[3] Mills, A. and S. Le Hunte, An overview of semiconductor photocatalysis. Journal of Photochemistry and Photobiology A: Chemistry, 1997. 108(1): p. 1-35.

