Secciones
- Oferta de Condorchem Envitech
- Introducción
- Usos del litio
- Metalurgia extractiva del litio
- Precipitación y refinación del cloruro de litio
- Soluciones de para la recuperación de litio de Condorchem Envitech
Oferta de Condorchem Envitech
Condorchem Envitech ofrece un conjunto de soluciones de alta eficiencia para la extracción, purificación y concentración de litio. Nuestro principal objetivo es ofrecer una solución competitiva y rentable que permita a las explotaciones mineras satisfacer el aumento en la demanda de litio que han experimentado en los últimos años:
Nuestras soluciones para la extracción, purificación y concentración de litio se dividen en los siguientes procesos:
- Diseño de un proceso personalizado de extracción de sales de litio
- Extracción y purificación fisicoquímica de efluentes de litio
- Concentración y cristalización de sales de Litio
- Ensayos de laboratorio: Balance de materia y eficiencias
- Plantas piloto industriales de demostración
Por otra parte, también ofrecemos soluciones integrales para la recuperación de litio, así como otros metales, en procesos de reciclaje de todo tipo de baterías.
Introducción
El litio se encuentra en la naturaleza en aproximadamente 145 minerales, pero solamente en algunos puede considerarse en cantidades comerciales, además de presentarse en salmueras, aguas termales y agua de mar, en cantidades muy diferentes que oscilan entre 20 ppm y 65 ppm.
Este elemento puede encontrarse de muy diversas formas, como ser en concentraciones anómalas de pegmatitas; en ambientes sedimentarios asociados con arcilla; en zonas de alteración hidrotermal asociados a minerales a bajas como a altas temperaturas; en evaporitas no marinas; en salmueras de ambientes desérticos; en aguas salinas o salmueras asociadas a yacimientos de petróleo; en yacimientos de boro; berilio, flúor, manganeso y posiblemente fosfato; en ambientes lacustre asociados a silicatos de magnesio; en aguas, plantas y suelos de ambientes desérticos; en rocas sedimentarias ricas en hierro.
A todo lo enumerado anteriormente, debe agregarse que los principales yacimientos que se encuentran en explotación, se ubican como pegmatitas o en salmueras de paleo depósitos lacustre salinos, y la gran mayoría de los factores de prospección sólo comprueban la presencia de concentraciones anómalas de litio, sin rendimiento económico en el mercado actual.
En Chile, el litio se encuentra en las áreas de depósitos salinos de la Alta Cordillera y, en menor proporción, en los campos de nitratos y yacimientos salinos asociados.
El litio tiene múltiples aplicaciones: Fabricación de baterías para ordenadores, teléfonos móviles y automóviles eléctricos (éstos subirán su demanda en extremo cuando se masifique su producción), específicos farmacéuticos para problemas de trastornos nerviosos (antidepresivos), purificación del aire ambiente, aleaciones para aeronáutica (Mg-Li), lubricantes industriales de base litio utilización en la industria nuclear como reguladores de pH del refrigerante, obtención de tritio para futuras generaciones de reactores de fusión nuclear.
El carbonato de litio (Li2CO3) es el compuesto de litio más utilizado; un gramo de litio está contenido en 5,32 gramos de carbonato de litio.
Chile es el primer productor de litio mundial con reservas conocidas en el Salar de Atacama del orden de 4.3 x 106 toneladas, siendo éste su mayor depósito correspondiendo al 40% de las reservas de interés económico a nivel mundial.
Con el ingreso al mercado de la Sociedad Minera Salar de Atacama Ltda., MINSAL, en 1998, Chile pasó a ser el primer productor y exportador mundial de litio, completando las 30.000 toneladas de concentrado, equivalentes al 50% de la demanda del mercado mundial, cifra con la que la Sociedad Chilena del Litio, SCL, lidera las exportaciones de este mineral.
Cada año, sólo en Japón se publican trabajos que contienen estudios de alrededor de 10.000 nuevos materiales, con propiedades físicas, químicas, eléctricas, magnéticas, iónicas y electroquímicas distintas. Están en perspectiva el desarrollo de nuevos productos como el cianuro, hidróxido y litio metálico.
Usos del litio
| Usos del litio | |
| Baterías | 35% |
| Cerámicas, vidrios, cementos | 32% |
| Grasas lubricantes | 9% |
| Aire acondicionado | 5% |
| Usos metalúrgicos | 5% |
| Síntesis de polímeros | 4% |
| Producción primaria de aluminio | 1% |
| Otros usos | 9% |
Los primeros usos comerciales del litio fueron en metalurgia empleándose pequeñas cantidades de aleaciones de aluminio-zinc-litio y aleaciones de plomo en las cuales se adiciona litio para endurecerlos.
Entre los años 1953 y 1959, la Comisión de Energía Atómica de los Estados Unidos consumió grandes cantidades de hidróxido de litio para separar el isótopo litio 6, el que fue usado en el desarrollo y producción de la bomba de hidrógeno.
Desde 1961 comenzó a desarrollarse el uso de compuestos como el bromuro de litio, en la forma de salmuera concentrada, para equipos de acondicionamiento de aire por absorción; el carbonato de litio para la industria de cerámica; el litio metálico, como intermediario en la síntesis de productos farmacéuticos; el Butil-litio como catalizador en la polimerización de la fabricación del caucho sintético.
Nuevos mercados se desarrollaron con múltiples propósitos, pero sigue siendo hoy día, el más importante mercado, la industria de las cerámicas, donde se utiliza el carbonato de litio como agente fundente en la preparación de esmaltes enlozados y vidrios.
Desde 1974 el uso del litio metálico como ánodo en baterías primarias empezó a mostrar un rápido crecimiento, puesto que, el litio es electroquímicamente reactivo, además de poseer otras propiedades únicas.
En 1980 la industria del aluminio desplazó del primer lugar a la cerámica y vidrio como principal usuario en volumen de productos de litio.
El desarrollo de las aleaciones de Li-Al, logran importantes avances en el desarrollo de nuevos usos, incorporando la participación a la investigación a los productores de aluminio, aeronáutica y militares.
Como resultado, se logra una aleación más liviana, adicionando el 1.5% al 3 % de Li a la aleación convencional de aluminio, la que puede ser empleada en componentes para aviones comerciales y militares, con este material de un 10% más liviano, se ahorra combustible, para alcanzar hasta un 20% de la capacidad de carga del avión.
Actualmente el consumo de litio metal para estas aleaciones es del orden de 45 toneladas anualmente, es decir unas 500.000 libras por año de carbonato de litio.
En el último tiempo, se han desarrollado piro cerámicas que encuentran una gran aplicabilidad en la industria aeroespacial, puesto que este tipo de material, al contener litio, hacen que las propiedades de expansión y compresión sean casi nulas, si el compuesto se encuentra bajo condiciones extremas de temperatura.
Estados Unidos sigue siendo el primer productor de compuestos de mayor valor agregado de litio y el principal consumidor de todo tipo de materiales de litio, con un consumo de 2800 toneladas métricas de contenido en litio el año 2000.
Los compuestos de litio además satisfacen las necesidades de la industria primaria de aluminio, componentes de baterías, aire acondicionado, lubricantes, sistemas de deshumidificación, producción de sofisticados textiles, desinfectantes para piscinas y baños, y como blanqueadores en lavanderías al seco.
La estructura cristalina del litio se estabiliza únicamente a causa de las fuerzas electrostáticas atractivas entre los iones fijos en los sitios de la red y los electrones libres, pero como sólo existen pocos electrones libres, las fuerzas atractivas que interactúan no son muy fuertes y por consiguiente la red de litio es débil y fácilmente deformable originando muy baja dureza.
Posee bajo punto de fusión, 180.5 ºC, sin embargo, la cantidad de calor que requiere a dicha temperatura para destruir la red y fundir el metal, es extremadamente alta.
Por esta razón, el litio es útil como resumidero de calor, particularmente en sistemas en que se requiere un bajo peso global en el diseño, lo que tiene gran importancia en la industria nuclear como material transportador de calor en circuito cerrado de reactores.
La facilidad con la cual el litio cede su electrón exterior, determina que sea un agente reductor súper potente y, como tal, reacciona velozmente con los agentes oxidantes menos potentes, por ejemplo, reacciona con el nitrógeno a temperatura ambiente para formar el nitruro Li3N, con el oxígeno del aire reacciona rápidamente formando el óxido Li2O y con el flúor genera la reacción más violenta de todos los elementos.
Debido a éstas propiedades el litio encuentra aplicaciones en sistemas de muy alta generación de energía electroquímica como las baterías de litio-cloro o de litio-azufre y varios otros tipos de pilas, constituyendo actualmente una industria en expansión.
El litio está formado por la combinación de isótopos, 7.4 % de litio 6 y 92.6 % de litio 7, lo que te da un peso atómico isotópico de 6.941.
El isótopo 6 tiene gran importancia, puesto que es la materia prima para la obtención del tritio H, que junto con el deuterio H serían los probables combustibles reactores de fusión nuclear (Tagger 1983), estimándose que estos reactores serán la solución del problema energético del mundo.
Las reacciones de formación del tritio y de generación de energía son las siguientes:
3Li6 + 0n1 — 2He4 + 1H3 + 4,78 Mev
Los neutrones provienen a su vez de la reacción:
1H2 + 1H3 —- 2He4 + 0n1 R + 17,6 Mev
En que NL y NR son neutrones lentos y rápidos. Sólo los neutrones lentos pueden ser eficaces para la conversión del litio 6 en tritio.
En el campo nuclear, los reactores del tipo PWR están evaluando la posibilidad de utilitzar otro elemento de efecto neutralizante y regulador en el refrigerante que no sea el hidróxido de litio.
Debido al precio, que actualmente se encuentra tensionado por la demanda de litio en el sector energético, la industria nuclear estudia la substitución por el KOH.
La tecnologia de regulación de pH mediante el hidróxido de potasio ya está probada en la tecnología nuclear rusa.
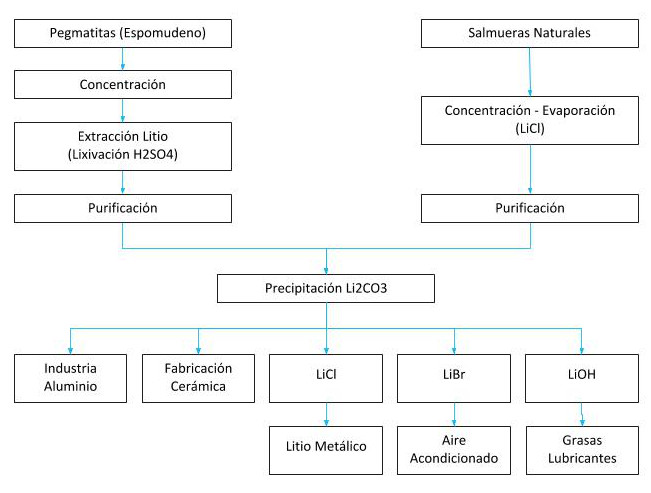
Menas principales de Litio y principales procesos extractivos
Metalurgia extractiva del litio
Se extrae de salmueras donde existe en sales naturales como en el Salar de Atacama en Chile, el Salar del Hombre Muerto y otros en Argentina, depósitos minerales como del espodumeno de Greenbush en Australia o una de las más grandes reservas de litio halladas en Bolivia, 21 millones de toneladas métricas en el Salar Boliviano de Uyuni.
Gran parte de la producción mundial de litio proviene de salmueras, cuyo costo de producción es mucho menor que de los depósitos minerales (según John McNulty $US 1.500-2300/ton y $USn4.200-4.500/ton respectivamente).
El litio se obtiene a partir de dos fuentes naturales, del mineral espodumeno que es un silicato doble de aluminio y litio (LíAISi2O6) que se encuentra asociado con el cuarzo, mica y feldespato.
La otra fuente de obtención es a partir de salmueras naturales de los salares y geysers, encontrándose en forma de sales de litio, principalmente, sulfato doble de litio y potasio (KLiSO4).
El litio puede obtenerse, como se mencionó anteriormente, a partir de un yacimiento de silicato doble de aluminio y litio (LiAlSi2O6 o Li2O·Al2O3·4SiO2), cuyos contenidos son 3.73% de Li y como óxido 8.03% de Li2O, los otros elementos están en relación del 51.59% O; 30.18% Si y como óxido de silicio 64.58% SiO2; 14.5% Al y 27.4% Al2O3.
El espodumeno (spodumene, proveniente originalmente de Grecia), también es conocido en américa como Kunzita, un cristal de dureza 6.5 a 7, que presenta una densidad 3.1 g/cc; además posee la característica de presentar diversos colores, que van desde gris claro, amarillo, verde hasta púrpura.
Las reservas o los recursos de litio de Bolivia están en salmueras, que tienen una densidad aproximada a 1,2 gramos por litro (g/l), por lo que una concentración de litio de 0,1% en peso equivaldrá a 1.000 partes por millón (ppm) y 1,2 g/l de concentración de la sal de litio.
La extracción de salmueras de litio se realiza mediante bombeo y la concentración del litio se puede realizar mediante dos procesos.
En primer lugar por medio de la adsorción mediante un adsorbente selectivo del litio (Polietilenglicol) y en segundo lugar mediante la evaporación en piscinas poco profundas construidas para el efecto.
La evaporación además de elevar la concentración de las sales, hace que al saturarse algunas de éstas se vayan precipitando.
La adsorción tiene las ventajas que no es influida por la composición del agua salada (puede tratarse salmueras con bajas concentraciones de litio como experimentalmente se lo hace con el agua de mar), ni por las condiciones meteorológicas del lugar y no se generan muchos residuos y las desventajas que son necesarios reactivos, el equipo de adsorción es caro y complicado y el costo del adsorbente elevado.
Las ventajas de la evaporación natural son que no se consume energía ni se utilizan muchos reactivos químicos, mientras que sus desventajas son la necesidad de usar simultáneamente otro método de separación, la acumulación de residuos y la dependencia de las condiciones meteorológicas del lugar (velocidad de evaporación y lluvias).
Habiéndose elegido este último método para el Salar de Uyuni (con el que funcionará la planta piloto ya instalada), solo se hará una breve descripción de éste.
La mayor producción mundial de litio proviene de las salmueras del Salar de Atacama en Chile, donde se utiliza el método de evaporación y del que se tienen datos y muchos factores de operación, que permiten su comparación con los del Salar de Uyuni.
Las salmueras de Atacama son más ricas que las de Uyuni en litio (también en potasio y boro), por lo que la relación Mg/Li, nociva para la concentración del litio es de 6/1 y 19/1 respectivamente.
Mientras que la evaporación y la pluviometría son de 3.200 mm/año y 10-15 mm/año en Atacama, en Uyuni son de 1.500 mm/año y 200-500 mm/año, vale decir que en Uyuni la evaporación es menor y la lluvia mucho mayor, lo que retardará bastante la evaporación.
En Atacama el proceso de evaporación que concentra el litio de 0,15% a 6% (40 veces) dura de 12 a 18 meses, por lo que es de prever que en Uyuni la evaporación dure mucho más, especialmente con lluvias intensas como las ocurridas últimamente que anegaron las piscinas de evaporación de la planta piloto.
| Principales minerales de litio | ||
| Mineral | % Li máx. | % Li comercial |
| Ambligonita | 4.73 | 3.7-4.2 |
| Eucriptia | 5.50 | 2.6-3.0 |
| Lepidolita | Variable | 1.4-1.9 |
| Petalita | 2.26 | 1.4-2.2 |
| Espomudeno | 3.73 | 2.6-3.0 |
| Contenido promedio de litio en salmueras explotadas | ||||||||
| Localización | % Li | % Na | % K | % Mg | % SO4 | % Cl | % B | Li/Mg |
| Bolivia: salar de Uyuni | 0.025 | 8.80 | 0.72 | 0.65 | 0.046 | 15.7 | 0.02 | 1/19 |
| Chile: salar de Atacama | 0.14 | 7.6 | 1.87 | 0.93 | 0.03 | 16 | 0.1 | 1/1.64 |
| Israel-Jordan: Mar Muerto | 0.0015 | 3.21 | 0.60 | 3.33 | 1.18 | 17.32 | 0.003 | 1/2200 |
| EEUU: Great Salt Lake, Utah | 0.004 | 8.0 | 0.65 | 1.00 | 0.016 | 14.0 | 0.006 | 1/250 |
| Silver peak, NV | 0.023 | 6.2 | 0.53 | 0.033 | 0.20 | 10.06 | 0.008 | 1/1.5 |
A modo de ejemplo con las salmueras obtenidas del Salar de Atacama se ha producido hasta 1997 sólo carbonato de litio, incorporando además a partir de 1998, el cloruro de litio en su proceso productivo.
La obtención del carbonato, a partir de estas salmueras podría resumirse en dos etapas: Concentración de las soluciones, mediante pozas de evaporación solar: Los contenidos iniciales de las salmueras del Salar de Atacama son alrededor de 0.17 % en Li, llegándose a concentrar hasta valores del orden de 4.3 % a 5.8% Li.
Tratamiento de la salmuera concentrada en planta química: Para la producción del Li2CO3 (99,5% de pureza), las salmueras concentradas son purificadas y cristalizadas, luego se realiza un proceso de carbonatación, una posterior precipitación y por último el secado de los cristales.
El proceso aplicado por la Sociedad Chilena de Litio (SCL), perteneciente a Foote Míneral Co., subsidiaria de Cyprus Amax Minerals Co, para la recuperación de litio fue desarrollado por esta empresa en su planta en Silver Peak, Nevada (U.S.A.), pero adecuándolo a las características propias de estas salmueras.
La producción de Chemetall Foote, cubre la demanda necesaria para la producción de compuestos de litio con mayor valor agregado, de sus plantas químicas ubicadas en los Estados Unidos y además, suple las necesidades de sus parientes Chemetall en Alemania y Taiwan.
Precipitación y refinación del Cloruro de litio
El estudio de laboratorio «Tratamiento químico de salmueras del Salar de Uyuni-Potosí» realizado en 1987 en Francia mediante el Convenio UMSA-ORSTOM (Instituto francés de investigación científica para el desarrollo), simulando en 5 vasos las condiciones de las piscinas de evaporación, estableció que precipita primero el cloruro de sodio (NaCl) y casi en seguida el cloruro de potasio (KCl).
Como el cloruro de magnesio (MgCl2) no puede ser separado con la evaporación, lo que complica el proceso, se lo precipita como hidróxido de magnesio (Mg(OH)2) añadiendo cal.
El cloruro de litio adecuadamente concentrado en los 5 vasos fue lavado con hidróxido de sodio para eliminar las posibles trazas de magnesio y calcio restantes, para finalmente precipitarlo como Cl-utilizando carbonato de sodio. La recuperación media del litio fue de 80,8% y la pureza media del Cl- 94,4%.
Tres pruebas de laboratorio recientemente realizadas con 25 litros de salmuera del Salar de Uyuni con 0,107% de litio, en el National Institute of Advanced Industrial Science and Technology del Japón, para la obtención de litio por el método de adsorción, dieron Cl- con una pureza superior al 99,8% y una recuperación media de 73%.
Este método es empleado en el Salar del Hombre Muerto, Argentina, que contiene 0,06% de litio.
El Cl- obtenido por cualquier método debe ser purificado, secado y cristalizado. A pesar del alto contenido de litio en el Salar de Atacama y la experiencia en su obtención, se indica que su recuperación es del 42%.
El Cl- a utilizarse en la fabricación de baterías para vehículos eléctricos debe tener una pureza de por lo menos 99,95%, por lo que el Cl- obtenido por precipitación debe ser refinado a través de varias reacciones y etapas de recristalización, en algunos casos mediante una resina de intercambio iónico.
Debido a que el proceso de refinación tiene costo y su recuperación es menor luego de cada etapa (en la etapa de refinación se estima en aproximadamente 70%), cuanto mayor la pureza del Cl-, su precio se incrementa en mucho mayor proporción.
Aunque el método descrito para la obtención de Cl- parece sencillo, como todo proceso industrial requiere de tecnología y logística adecuadas, de técnicos experimentados y personal entrenado.
La evaluación del funcionamiento de la planta piloto permitirá confirmar o cambiar el proceso de concentración de litio mediante piscinas de evaporación.
| Solubilidades del Li2CO3 y LiCl en gr/100gr H2O | ||||||||||||
| Temp. ºC | 0 | 5 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 100 |
| Li2CO3 | 1.52 | – | 1.41 | 1.31 | – | 1.24 | 1.16 | 1.07 | 1.00 | – | 0.84 | 0.70 |
| LiCl2 · 2H2O | 40.9 | 42 | 42.7 | – | – | – | – | – | – | – | – | – |
| LiCl2 * H2O | – | – | – | – | 45.85 | 46.3 | 47.3 | 48.3 | 49.6 | 51.1 | 52.8 | 56.511 |
| Fuente: Linke y Siedell, 1965. 1Hutting and Steudemann, 1927 **Tomados por Kraus and Burgess, 1929; densidad de la sol.saturada 1.017 a 0ºC y 1.014 15ºC | ||||||||||||
Ejemplo 1. Proceso de tratamiento de las salmueras ricas en Li en Atacama (Chile)
El carbonato de litio, es el compuesto base más importante entre las sales de Li, su demanda representa el 60% de los productos de Li.
Su importancia principalmente radica en que es fácil de purificar y sirve para la conversión de otras sales de litio inorgánico y orgánico tales como, Lico, LiBr y LiOH-H2O y otros compuestos.
Se estima que la producción mundial es de 45.000 toneladas anuales, siendo Chile el principal productor, mientras que el principal consumidor de carbonato de litio es Estados Unidos.
La extracción de las salmueras del Salar de Atacama ha sido realizada por la Sociedad Chilena del Litio, desde 1984, la cual cuenta con una planta con capacidad de producción de 11.800 toneladas al año de Li2CO3.
La extracción de las salmueras del salar, Figura Nº7, se realiza mediante bombas que succionan la salmuera a 30m de profundidad, descargándolas a través de cañerías a un sistema de pozas de evaporación solar, donde el Li se concentra desde 0.17% a 4.3%.
La construcción de las pozas dentro del salar, se efectuó rompiendo la costra salina y dejando una superficie plana en la cual yace una capa de arcilla. Tanto los diques como el fondo de 1as pozas de evaporación se revistieron con un plástico resistente de 0.5mm de espesor.
La protección del poliuretano se logra con una capa de sales de NaCl de aproximadamente 30cm de espesor. Durante el proceso de evaporación, precipitan sales en las pozas en forma secuencial, las que son cosechadas y descartadas como impurezas: halita (NaCl), silvinita (NaCl + KCl), carnalita (KCl x MgCl2 x 6H2O) y bischofita (MgCl2 x 6H2O).
En las pozas de mayor concentración precipita carnalita de litio. (LiCl-MgCl2 x 7H2O), con el objeto de recuperar el litio que contiene, es repulpeada y lavada con una solución saturada en cloruro de magnesio, pero no saturada en cloruro de litio.
La bischofita (MgCl2 x 6H2O) presente y no disuelta, se separa por centrifugación y es eliminada del sistema. La salmuera finalmente así concentrada alcanza 5,8% Li, 20% Mg y 0.7% B expresada como ácido bórico (H3BO3), encontrándose lista para ser transportada a la planta química ubicada en Antofagasta a 170 km del Salar de Atacama.
El tratamiento químico en la Planta La Negra consiste en eliminar el magnesio remanente, en dos etapas de purificación, como carbonato e hidróxido de magnesio, respectivamente.
Para ello, la salmuera concentrada se diluye hasta un contenido de 0,6% de Li, con el agua madre proveniente de la etapa final de precipitación del carbonato de litio.
Este producto se obtiene por reacción en caliente (alrededor de 85ºC), entre la salmuera purificada libre de magnesio (1ppm) y una solución de Na2CO3, precipitando el Li2CO3.
El producto final se seca y se comercializa en cristales (70%), o bien se compacta para ser vendido en forma de gránulos (30%).
La pureza del producto es cercana al 99.5% Li2CO3. No obstante, su contenido en boro (400-600 ppm) impide su utilización como materia prima para la fabricación de litio metal, vía cloruro de litio.
2LiCl + Na2CO3 == Li2C03 + 2NaCl
Con el objeto de resolver el problema anterior y poder lograr un carbonato de litio con las mayores especificaciones exigidas por el mercado, FOOTE diseñó un proceso que permite eliminar el boro de la salmuera, mediante extracción por solvente, en una etapa previa a la separación del magnesio remanente.
La unidad de extracción líq-líq, primeramente separa el boro remanente de la salmuera concentrada procedente del salar, para luego proseguir con el proceso anteriormente descrito. Finalmente se obtiene un producto final de carbonato de litio con contenidos bajísimos en boro (inferiores a 5 ppm).
En una primera etapa es lixiviado la mayor parte de magnesio, el proceso conduce a la formación de una solución de cloruro de litio con bajo contenido de sulfato, finalmente se trata con carbonato de sodio, para la obtención de carbonato de litio.
En 1998 MINSAL estimó una producción de 9.000 toneladas de Li2CO3 con capacidad sobre las 20.000 ton/año. Esta compañía ha estado considerando la expansión para construir una planta de butil-litio en Texas y así facilitar la producción de materiales de batería.
El proceso desarrollado por MINSAL, es muy diferente en sus primeras etapas al que utiliza SCL, ya que contempló la utilización como materia prima de sales cosechadas de las pozas que contenían sulfato de litio.
En 1997, SQM, líder en la comercialización del salitre, inicia la comercialización y producción de carbonato de litio, a partir de las salmueras del Salar de Atacama.
Una fracción de la salmuera resultante del proceso de evaporación solar para la producción de cloruro de potasio continúa su proceso de concentración y se constituye en la fuente de litio a partir de la cual SQM produce el carbonato de litio en una planta ubicada en el Salar del Carmen.
La salmuera concentrada en litio es transportada en camiones desde el Salar de Atacama hasta la planta, donde es purificada para extraerle primero, su contenido remanente de boro y luego magnesio mediante procesos de extracción y de filtración.
Finalmente, la salmuera purificada de litio reacciona con carbonato de sodio para para producir el carbonato de litio el cual es filtrado, lavado, secado y envasado en distintos formatos de productos que abarcan desde productos finos, como los utilizados en la industria de las baterías recargables de ion litio, hasta productos granulares que son usados en el proceso de producción del aluminio.
Ambas compañías, SQM y FMC (SCL), transportan las salmueras concentradas desde el salar hasta sus plantas ubicadas en Antofagasta y prácticamente cubren el mercado global americano (88% del litio es que importa Estados Unidos es proveniente de Chile, el 7.5% de Argentina y el resto son pequeñas cantidades de China, Japón.
El proceso de obtención del cloruro de litio, a partir del carbonato o de hidróxido de litio, se puede lograr reaccionando con ácido clorhídrico,
Li2CO3 + 2HCl === 2LiCl + H20 + C02
LiOH·H2O + HCl === LiCl + 2 H2O
Para eliminar el sulfato y el calcio que contiene la salmuera de carbonato, es necesario agregar ácido oxálico y cloruro de bario al reactor. Posteriormente, la salmuera es filtrada para eliminar sus impurezas.
A continuación, el sistema pasa a la etapa de cristalización, centrifugación y secado. El cloruro de litio cristalizado es lavado con agua enfriada en contracorriente y posteriormente es tamizado.
A partir de LiCl es posible obtener Li metálico, el cual es de utilidad en las aleaciones de Li-Al y en baterías primarias (fuentes de energía).
Una de las ventajas de este elemento es calentarse hasta 600ºC sin que se llegue a descomponerse. Al ser calentado a 800ºC en atmósfera de hidrógeno, se descompone parcialmente en óxido de litio y gas carbónico, compuesto poco soluble.
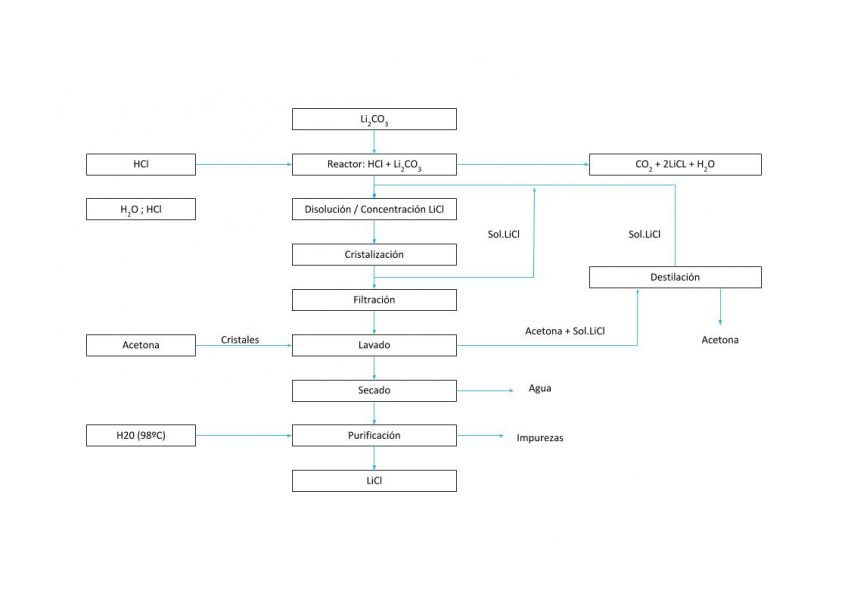
PROCESO DE CRISTALIZACIÓN LiCl
Proceso Quimico sin evaporación Natural
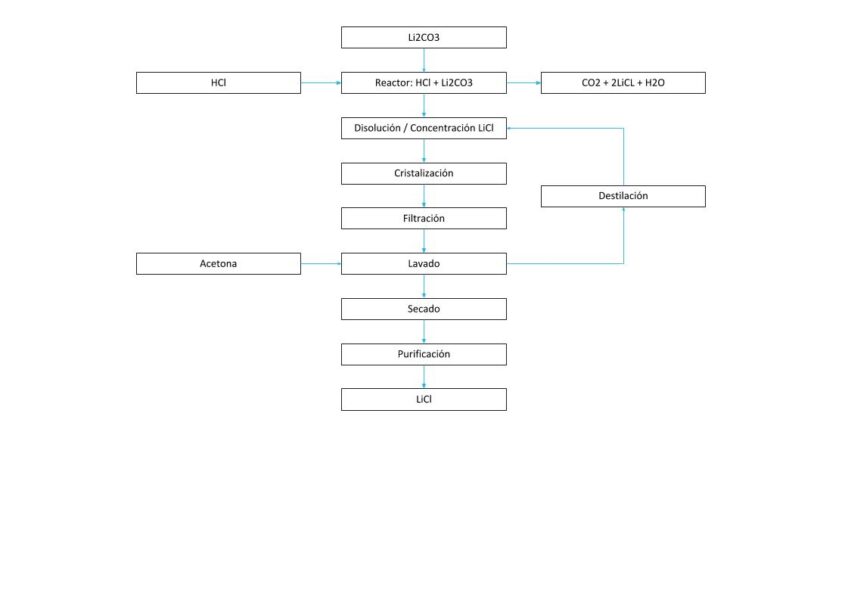
PROCESO DE CRISTALIZACIÓN DE LITIO (2)
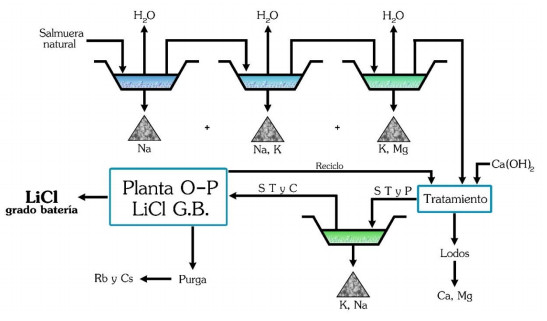
Ejemplo 2.Proceso diferencial de Obtención de LiCl
En una sucesión de pozas de evaporación secuenciales como se indica en el diagrama anterior precipitan cloruros de sodio, sodio y potasio, potasio y magnesio debido a la solubilidad diferencial.
Una vez alcanzada una concentración aproximada de 6% de LiCl se agrega cal para precipitar el magnesio y se puede eliminar el boro como éster de alcohol isopropílico por extracción por solventes con recuperación de los mismos por destilación.
D. Galli ha descripto estos procesos en detalle en la patente de la empresa ADI que corresponde a la explotación del salar de Rincón en Salta.
Esquema de pozas en el proceso evaporítico. Fuente Dr. D. Galli.
Luego del agregado de cal se separan Mg, Ca y B y el proceso puede seguir diversas alternativas según el compuesto de litio que se desee obtener: mediante el agregado de soda Solvay se precipita el carbonato de litio impuro que luego por inyección de CO2 se convierte en bicarbonato de litio, que luego de filtración y calentamiento permite obtener Li2CO3 grado batería.
Alternativamente, por electrodiálisis de la solución concentrada de cloruro de litio se puede obtener LiOH.H2O y LiCl de alta pureza. La empresa Simbol ha desarrollado un método que ha patentado para la purificación de LiOH por electrodiálisis de LiCl para obtener grado batería.
Alternativamente al proceso anterior puede tratarse la salmuera en columnas de resinas de intercambio que separan los contaminantes para luego agregar soda Solvay para obtener carbonato de litio de alta pureza. Debe señalarse que la elución y regeneración de las columnas conlleva a la formación de grandes volúmenes de residuos líquidos.
El proceso cal-sodada (soda-lime) permite la eliminación del Mg2+ y SO42– por precipitación de sulfato de Mg y Ca que constituyen lodos contaminantes si bien pueden utilizarse para consolidar caminos en el desarrollo del salar o bien como material Litio.
Un recurso natural estratégico ignífugo de relleno para construcciones. El boro debe eliminarse por su efecto negativo en la obtención de litio metálico para lo cual se procede a extracción con solventes como alcohol isopropílico que forma ésteres.
Con el método cal-sodada se obtiene Li2CO3 grado técnico (> 99,5%) que puede re-disolverse como bicarbonato soluble, LiHCO3, burbujeando CO2, filtrar y por aumento de la temperatura eliminar CO2 y precipitar el carbonato de litio grado batería (>99,9%), con reciclado de CO2.
Es importante señalar que este proceso podría implementarse como fijación de dióxido de carbono atmosférico con la consecuente ganancia en bonos verdes. El cloruro de litio puede llevarse a alta pureza por redisolución en isopropanol que debe destilarse para recuperar el solvente.
También el carbonato de litio puede disolverse en HCl y tratarse en columnas de intercambio iónico para obtener LiCl de alta pureza. Finalmente el litio metálico se obtiene por electrólisis de una mezcla eutéctica fundida de KCl-LiCl a unos 400 ºC bajo atmósfera de argón.
El uso de solventes más caros que el agua es costoso por lo que deben recuperarse por destilación que aumenta los costos en energía por lo que debe evaluarse cuidadosamente su incidencia en el costo del producto final.
Salares de alto contenido en Mg como Atacama y Uyuni presentan un problema por la floculación del hidróxido de magnesio durante la precipitación con cal.
En esos casos es conveniente la remoción inicial del magnesio por precipitación con Ca(OH)2 antes de la etapa de concentración por evaporación bajo radiación solar. En salares de alto contenido en magnesio se prefiere la ruta por sulfatos en lugar de cloruros.
Ejemplo 3. Recuperación selectiva de litio.(LiOH)
La recuperación selectiva de litio a partir de salmueras con un contenido menor al 1% en presencia de altas concentraciones de otros iones alcalinos y alcalinotérreos es un objetivo industrial.
Los procesos evaporíticos se basan en solubilidad diferencial de sales de litio en soluciones concentradas de las salmueras, o sea recristalización fraccionada.
Alternativamente se han diseñado procesos químicos y electroquímicos selectivos a la recuperación de cloruro, hidróxido o carbonato de litio de alta pureza que buscan reducir los tiempos de proceso y disminuir el impacto ambiental por pérdida de agua y formación de residuos ambientalmente nocivos.
Recientemente se ha propuesto un método rápido basado en la precipitación de fosfato de litio, Li3PO4 poco soluble (0,39 g/l) por tratamiento de salmueras con ácido fosfórico; luego se trata el fosfato de litio insoluble con cal para formar hidroxiapatita muy insoluble y recuperar hidróxido de litio soluble.
3Li3PO4 + 5Ca(OH)2 -> Ca5(PO4)3OH + 9LiOH
Procesos de extracción de litio de sus depósitos en salares Argentinos. En este proceso el ácido fosfórico se recupera por tratamiento de la hidroxiapatita con ácido sulfúrico, con formación sulfato de calcio hidratado (yeso) que tiene aplicaciones en construcción:
Ca5(PO4)3OH + 5H2SO4 -> 5CaSO42H2O + H3PO4
Este método ha sido patentado por la empresa siderúrgica coreana Posco quienes han instalado una planta piloto en Cachauri, Jujuy, en 2015.
El método no procesa salmueras por evaporación por lo que es significativamente más rápido que los métodos evaporíticos, sin embargo debido a que utiliza ácido fosfórico, que si bien se recupera, puede dejar residuos de fosfatos de magnesio y calcio en forma de lodos contaminantes.
Métodos de adsorción
Se ha estudiado extensamente la adsorción selectiva del litio contenido en salmueras (300-1000 ppm) y agua de mar (0.125 ppm) utilizando adsorbentes como MnO2, TiO2, hidróxido de aluminio, etc. La captación de litio en estos sistemas depende de la intercalación de iones litio en redes no estequiométricas de estos óxidos con una capacidad que varía con el tipo de adsorbentes en 3-35 mg/g.
Cuando se extrae de soluciones ricas en iones litio como las salmueras (> 5 mg/L) se pueden lograr captaciones de > 20 mg/g. En ciertos casos existe co-inserción de otros iones presentes en las salmueras como Mg, Na, K, Ca, etc.
El óxido de manganeso se ha estudiado como adsorbente en variadas matrices como tamices iónicos de MnOx con posterior recuperación de litio por lixiviación con ácido para dar por ejemplo Li0.15H0.76Mg0.40MnIII0.08MnIV1.59 O4.
El óxido de estructura cúbica espinela -MnO2 puede incorporar 38 mg/g para dar LiMn2O4 por intercalación en la red cúbica.
Esta alternativa ha sido evaluada por investigadores coreanos en Uyuni (Bolivia), sin embargo la estabilidad del óxido en columnas de lixiviado no fue suficiente para el proceso en escala industrial.
Por tratamiento ácido que reemplaza al ion litio por protones en la estructura cristalina durante la elución se produce la disolución del óxido mixto y se eluyen otros iones como Ca2+, Mg2+, etc.
Se ha prestado atención a rocas que pueden captar litio en la corteza terrestre como sistemas modelo para la adsorción y absorción de litio en sus estructuras.
Por ejemplo la gibsita, un mineral de hidróxido de aluminio se ha estudiado en detalle para la captación de litio. Varias empresas han patentado métodos de recuperación de litio utilizando diversas formas de hidróxido de aluminio amorfo, entre ellas Dow Chemical Co., FMC (Foot Mineral Company), Simbol Inc., Posco, etc.
La corporación minera internacional FMC, con operaciones en Argentina en el Salar del Hombre Muerto (Catamarca) por medio de su subsidiaria Minera del Altiplano S.A. utiliza un método de tecnología propietaria que se basa en intercambio iónico con zeolitas, probablemente de tipo gibsita controlado por temperatura.
En estos métodos se extraen los iones litio de salmueras concentradas que contienen LiCl luego de una pre-concentración a 9 g/L generalmente por evaporación solar. Luego se circula el líquido por una columna de hidróxido de aluminio hidratado policristalino soportadas en material aglomerado hasta saturación de litio.
En una segunda etapa se desplaza el LiCl del intercambiador iónico con una solución concentrada de NaCl repetitivamente y finalmente con solución diluida de LiOH.
Resinas de intercambio iónico tales como Zeo-karb 225, Dia-ion, SK, AG50WX8, con grupos sulfonatos y agentes quelantes se han utilizado para captar litio de salmueras sintéticas.
También ha sido propuesta la extracción con solventes orgánicos de litio atrapado con agentes orgánicos. En estos casos es crítico el costo de las resinas, la energía involucrada en su regeneración y el costo de solventes y su posible impacto ambiental por los efluentes.
Métodos electroquímicos
Entre los métodos extractivos de litio de salmueras que tengan bajo impacto en pérdida de agua por evaporación ni alteren el ambiente con residuos químicos como NaCl o MgSO4 y a su vez no tengan un costo excesivo se encuentran los métodos electroquímicos.
Kanoh informó la intercalación de iones litio en cátodos de λ-MnO2 utilizando una celda electroquímica con ánodo de platino y estudió la cinética de inserción/extracción iónica λ-MnO2/LiMn2O4 en contacto con soluciones de LiCl.
El inconveniente de esta celda es la reacción en el ánodo que modifica el pH de la salmuera por descomposición del agua. La Mantia y colaboradores utilizaron celdas entrópicas para extraer litio utilizando electrodos de tipo batería cátodo de LiFePO4 y ánodo Ag/AgCl, sin cambios de pH en la salmuera pero con un alto costo de la plata y la disolución en soluciones muy concentradas de cloruro.
Más recientemente estos autores introdujeron un ánodo de hexaciano-ferrato de níquel que intercambia cationes como alternativa al electrodo de Ag/AgCl. Una celda electroquímica similar combinando λ-MnO2 con ánodo de Ag es reportada por Lee para extraer litio de salmueras artificiales.
Kim a su vez, utilizó el mismo cátodo de óxido de manganeso combinado con un electrodo capacitivo de carbono en una configuración de supercapacitor.
Estas configuraciones han sido analizadas recientemente por Missoni. Métodos similares altamente selectivos a litio respecto de sodio emplean un proceso electroquímico con un cátodo tipo batería de la estructura olivina LiFePO4 recubierto de dopamina con I- /I3 – .
Hoshino propuso electrodiálisis con una membrana de líquido iónico pero de muy baja velocidad de extracción.
Merece un comentario el método propuesto por Liu con dos electrodos de LiFePO4 y FePO4 separados por una membrana permeable a los aniones para la extracción de litio de salmueras.
Los iones litio producidos en el LiFePO4 se combinan con aniones X- aumentando la concentración de LiX, mientras que en el electrodo FePO4 se intercalan iones litio disminuyendo la concentración de LiX en ese compartimento.
En los procesos de extracción de litio de depósitos en salares Argentinos, investigadores argentinos en INQUIMAE han desarrollado un método alternativo de extracción de litio a partir de salmueras naturales de la Puna, que ha sido patentado por CONICET.
Este método electroquímico es rápido, tiene bajo impacto ambiental por no agregar sustancias químicas ni producir desechos, bajo costo energético y es altamente selectivo a la extracción de LiCl.
Se ha realizado la prueba de concepto y actualmente se desarrolla la ingeniería para el desarrollo y escalado de reactores. La salmuera circula por una celda electroquímica no dividida por membrana que utiliza como cátodo un óxido de litio y manganeso del tipo batería Li1-XMn2O4 (LMO) (0 x 1) que capta selectivamente Li+ por intercalación en el sólido, y el polímero conductor polipirrol (PPy) como ánodo que capta selectivamente iones Cl- por compensación de carga al oxidar este electrodo pseudocapacitivo.
En primer lugar se expone la salmuera a los electrodos de Li1-xMn2O4 reducido y PPy oxidado y espontáneamente se capta el LiCl con generación de energía.
Luego de enjuagar los electrodos se reemplaza la salmuera por un electrolito diluido y se invierte la polaridad de la celda con lo que se recupera el LiCl en solución.
Bajo una diferencia de potencial de menos de 1 V, los iones Li+ se intercalan en el Li1-XMn2O4 y los iones Cl- se adsorben en el PPy oxidado.
La energía necesaria para el segundo proceso y para las bombas de extracción y circulación se puede obtener de paneles solares en la región de la Puna con radiación solar de más de 2.600 kWh/m2 durante todo el año, lo que la hace de las mejores regiones del planeta para la cosecha de energía solar.
Se ha evaluado que la inversión de capital en paneles solares con una vida útil de 30 años es de sólo 10 dólares por tonelada de cloruro de litio extraída.
Durante la captación de LiCl, sólo los iones Li+ se intercalan selectivamente en el óxido de manganeso en contacto con salmuera altamente concentrada que contiene sodio, potasio, magnesio, etc.
La espinela LiMn2O4 es una fase estable con la mitad del contenido de litio en la descarga desde λ-MnO2 a Li2Mn2O4. El LiMn2O4 tiene la estructura cúbica espinela (grupo espacial Fd3m) y celda cristalina unitaria conteniendo 56 átomos: Una estructura empaquetada de iones oxígeno en 32 sitios con 16 Mn en sitios octaédricos (MnO6) y 6 litios en sitios tetraédricos 8a.
La inserción y extracción de iones Li+ tiene lugar por un proceso topo táctico dentro de la estructura cúbica con expansión isotrópica como se revela por el corrimiento de reflexiones en difractometría de rayos X.
Mediante un electrodo selectivo a iones cloruros es posible extraer cloruro de litio de las salmueras con alta selectividad ajustando el potencial redox del sistema MnIII/MnIV en la estructura cristalina.
Debido a la existencia de dos tipos de sitios tetraédricos no equivalentes para el Li+ en la espinela se observan dos procesos de oxidación-reducción en este material de electrodo positivo en baterías.
El proceso de extracción de cloruro de litio de la salmuera es altamente selectivo y eficiente dentro de la estequiometria LiMn2O4/λ-MnO2 con alta reproducibilidad por más de 200 ciclos de carga y descarga, bajo consumo de agua, y bajo consumo energético 5 Wh/mol basado en carga y 10 Wh/mol basado en la concentración de litio recuperado.
No se ha observado co-inserción de iones sodio o magnesio en el óxido de manganeso por evidencia de difracción de rayos X.
Actualmente se desarrolla la ingeniería de detalle y escalado de reactores electroquímicos para la extracción de litio a partir de salmueras naturales mediante este método [32].
El LiMn2O4 tiene una capacidad de captación de litio de 38 mg/g, por ser el metal más liviano el litio puede almacenar mucha carga por unidad de masa.
Sin embargo cuando se lo recupera electroquímicamente se requiere mucha carga: cada 7 g de litio requieren una carga de 1 Faraday o sea 26,8 Ah, lo que ha dado lugar a la “paradoja del litio” por Procesos de extracción de litio de sus depósitos en salares Argentinos lo que es clave el cuidadoso diseño del reactor con electrodos tridimensionales de gran área específica.
Soluciones para recuperación de litio de Condorchem Envitech
Nuestras soluciones para ayudar a la extracción de litio de la espodumena son:
- Solución 1. Concentración de la solución de Li2SO4
- Solución 2. Purificación de Li2CO3
- Solución 3. Recuperación de Na2SO4 como subproducto durante la producción de Li2CO3.
- Solución 4. Producción de LiOH por reacción de Li2CO3 con cal
- Solución 5. Producción de LiOH por electrodiálisis
- Solución 6. Producción de LiCl
Solución 1. Concentración de la solución de Li2SO4
El proceso de ácido sulfúrico para la extracción de litio normalmente implica:
- Proceso de calentamiento a 1100ºC en un horno rotatorio (la α-espodumena se convierte en β-espodumena)
- La β-espodumena se muele, se mezcla y se tuesta con H2SO4 a 250ºC.
- En esta etapa, se genera Li2SO4 (soluble en agua) y un insoluble residuo de mineral. El exceso de H2SO4 se neutraliza con CaCO3.
- El horno se lixivia luego con agua.
- Filtración para remoción de impurezas.
- Adición de cal para precipitar magnesio y carbonato de sodio para precipitar calcio residual.
- Ajuste de pH con H2SO4 y concentración de solución de Li2SO4 por múltiples Efecto evaporación (triple efecto) [1]. Se requiere una solución que contenga litio altamente concentrada
- Finalmente, el litio puede precipitarse como Li2CO3 mediante la adición de carbonato de sodio. Después de la cristalización, se produce carbonato de litio de grado técnico.
La utilización de la evaporación de efectos múltiples puede ayudar al proceso de concentración de litio antes de la precipitación de carbonato de litio.
Solución 2: Purificación de Li2CO3
El carbonato de litio de grado técnico se redisuelve para eliminar las impurezas.Mediante recristalización, se puede producir carbonato de litio de grado de batería.
La utilización de tecnologías de cristalización puede facilitar la producción de carbonato de litio de grado de batería.
Solución 3: recuperación de Na2SO4 como subproducto durante el litio
Producción de carbonato
- Se agrega Na2CO3 a una solución concentrada de Li2SO4 para precipitar el carbonato de litio
- Por evaporación y cristalización, se obtiene carbonato de litio
- Una solución residual que contiene sulfato de sodio puede eventualmente concentrarse en un cristalizador para la recuperación de Na2SO4 (subproducto).
La utilización de tecnología de evaporación-cristalización puede facilitar la recuperación de sulfato de sodio (subproducto).
Solución 4. Producción de LiOH por reacción de Li2CO3 con Ca(OH)2
Li2CO3 + Ca (OH)2 –> 2LiOH + CaCO3
Se puede producir un LiOH monohidrato por evaporación-cristalización.
La utilización de tecnologías de cristalización proporcionadas por Condorchem Envitech puede ayudar durante la producción de LiOH a partir de Li2CO3.
Solución 5. Producción de LiOH por electrodiálisis
Durante el tratamiento de electrodiálisis (ED) de una solución de Li2SO4, la cámara del cátodo se enriquece con LiOH mientras que el ánodo se enriquece en H2SO4.
Sin embargo, otros metales alcalinos como sodio y potasio también se enriquecerán en la cámara del cátodo.
Esto podría resolverse implementando un proceso de cristalización después de la DE. La solubilidad de NaOH y KOH es 10 veces mayor que la solubilidad de LiOH. Por lo tanto, es factible precipitar la mayor parte del LiOH mientras se mantiene el NaOH y el KOH en la solución.
La utilización de tecnologías de cristalización proporcionadas por Condorchem Envitech puede ayudar durante la producción de LiOH.
Solución 6. Producción de LiCl
El cloruro de litio se puede producir mediante el tratamiento de carbonato de litio con HCl.
Li2CO3 + 2HCI –> 2LiCI + H2CO3
La utilización de tecnologías de cristalización proporcionadas por Condorchem Envitech puede facilitar el proceso de producción de LiCl.
Solución 7. Tratamiento de relaves
Se apunta a una solución ZLD. Pueden existir oportunidades para la recuperación de agua y metales. Volumen de efluente reducido.
Se requiere una combinación de tecnologías de tratamiento de agua y desechos sólidos.
La utilización de tecnologías de concentración basadas en membranas y evaporación proporcionadas por Condorchem Envitech puede facilitar una solución ZLD.
Referencias bibliográficas
[1] O. A. Hougen, K.M. Watson, R. A. Ragatz, Principios de los Procesos Químicos. Parte
II Termodinámica, Editorial Reverté, Madrid, 1964.
[2] O. A. Hougen, K.M. Watson, R. A. Ragatz, Principios de los Procesos Químicos. Parte I
Balances de Materia y Energía, Editorial Reverté, Madrid, 1964.
[3] J. M. Smith, H. C. Van Ness, Introducción a la Termodinámica en Ingeniería Química,
3ª Edición, Editorial McGraw-Hill, 1982.CAP.1. INTRODUCCIÓN 9
[4] Roine, A., HSC Chemistry Software, Versión 5.11, Outokumpu Research Oy,
Información Servie P. O. Box 60 FIN-28101 PORI, Finland, 2005.
[5] L. David, Parkhurst, C. A. J. Appelo, User’s Guide to PHREEQC (version 2), U. S.
Geolical Survey Box 25046, MS 418, Denver, Colorado, 1999.
[6] gPROMS ModelBuilder version 2.3.1, Process Systems Enterprise Limited, 2004.
[7] K. S. Pitzer, J. Phys. Chem., 77(1973) 268-277.
[8] H. Renon, J. M. Prausnitz, AIChe J., 14 (1968) 135-144.
[9] C.F. Weber, Eng. Chem. Data, 39 (2000) 4422-4426.
[10] Y. Li, P. Song, S. Xia, S. Gao, CALPHAD, 24 (2000) 295-308.
[11] F. Farelo, C. Fernandes, A. Avelino, J. Chem. Eng. Data, 50(2005) 1470-1477.
[12] C. Monnin, M. Dubois, N. Papaiconomou, J. P. Simonin, J. Chem. Eng. Data, 47 (2002)
1331-1336.
[13] Chr. Christov, Chr. Balarew, S. Petrenko, Vl. Valyashko, Journal of Solution Chemistry,
23 (1994) 595-604.
[14] Z. Li, T. Deng, M. Liao, Fluid Phase Equilibria, 293 (2010) 42-46.
[15] Chr. Christov, Computer Coupling of Phase Diagrams and Thermochemistry, 36 (2012)
71-81.
[16] D. Zeng, Z. Wu, Y. Yao, H. Han, J. Solution Chem, 39 (2010) 1360-1376.
[17] J. M. Prausnitz, R. N. Lichtenthaler, E. G. Azevedo, Molecular Thermodynamic of
Fluid-Phase Equilibria, Prentice-Hall, Inc, Englewood Cliffs, NJ, 1998.
[18] D. A. Weingaertner, S. Lynn, D. N. Hanson, Ind. Eng. Chem. Res., 30 (1991) 490-501.
[19] T. A. Graber, H. Medina, H. R. Galleguillos, M. E. Taboada, J. Chem. Eng. Data, 52
(2007) 1262-1267.
[20] Y. T. Wu, D. Q. Lin, Z. Q. Zhu, L. H. Mei, Fluid Phase Equilibria, 124 (1996) 67-69.