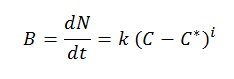La cristalización es un método de separación en el que se produce la formación de un sólido (cristal o precipitado) a partir de una fase homogénea, líquida o gaseosa. El sólido formado puede llegar a ser muy puro, por lo que la cristalización también se emplea a nivel industrial como proceso de purificación. La cristalización de sal, o tratamiento de salmueras, es un proceso muy habitual en procesos industriales que generan aguas residuales.
Para que la cristalización se pueda llevar a cabo es condición indispensable que la solución se encuentre sobresaturada. Los procesos de cristalización difieren unos de otros en el método mediante el cual se consigue la sobresaturación. En general, se puede conseguir de tres modos diferentes:
- Sobresaturación producida por enfriamiento de la solución con evaporación despreciable.
- Sobresaturación producida por evaporación del disolvente con poco enfriamiento.
- Evaporación por combinación de enfriamiento y evaporación en evaporadores adiabáticos (cristalizadores al vacío).
Cabe tener presente que para utilizar los cristalizadores en los que la sobresaturación se logra mediante enfriamiento, los solutos deben tener una curva de solubilidad que disminuya significativamente con la temperatura. En aquellos casos en que la solubilidad no depende prácticamente de la temperatura, la sobresaturación se consigue evaporando el disolvente. Y cuando se utiliza la combinación de enfriamiento y evaporación, una solución se somete a condiciones de vacío para que el disolvente se evapore de manera repentina y la solución se enfríe adiabáticamente.
Este último método es el más utilizado a nivel industrial para provocar la sobresaturación. A la práctica, existe una amplia variedad de cristalizadores industriales, cada uno diseñado específicamente para conseguir de forma óptima la sobresaturación de la solución, en función de las características y propiedades de ésta.
El proceso de cristalización no es sencillo y la etapa más importante consiste en la formación de cristales sólidos en el seno de la solución líquida. La solución se concentra y se enfría hasta que la concentración del soluto es superior a la solubilidad a dicha temperatura y el soluto forma cristales casi puros.
La velocidad de crecimiento de un cristal se conoce como velocidad de cristalización. El crecimiento ocurre primero con la formación del núcleo y luego su crecimiento se va produciendo de forma gradual. Cuando la concentración es superior a la sobresaturación, la nucleación –formación de núcleos– se produce de forma natural, espontánea y rápida. La velocidad de cristalización se puede expresar mediante la siguiente ecuación empírica:
Dónde:
- B: velocidad de nucleación (núcleos formados por unidad de tiempo y de volumen de solvente)
- N: número de núcleos formados por unidad de volumen de solvente
- t: tiempo
- k, i: parámetros empíricos
- (C-C*): sobresaturación
- C: concentración del soluto en la solución
- C*: concentración de saturación del soluto
De la ecuación se deduce que la velocidad de nucleación es función directa de la sobresaturación. Se ha comprobado que cuando la sobresaturación es elevada, la velocidad de nucleación –y también la velocidad de crecimiento del cristal– también son elevadas, dando lugar a cristales pequeños, imperfectos y con impurezas. Y al revés, cuando la sobresaturación es baja, la velocidad de formación es pequeña, el crecimiento de los cristales es regular y se obtienen cristales de gran tamaño y de elevada pureza.
En la cristalización se distinguen principalmente dos pasos: la nucleación y el crecimiento de los cristales. Ambos procesos se producen, si las condiciones son favorables, en la zona sobresaturada de la gráfica. No obstante, para la nucleación se requiere más sobresaturación que para el crecimiento. El área de formación nuclear donde se da la sobresaturación se denomina zona inestable, mientras que el área de crecimiento se conoce como zona metaestable. Para la nucleación es necesario que la solución llegue a la zona inestable. Sin embargo, una vez allí́, los núcleos crecerán demasiado rápido y los cristales resultantes serán muchos y muy pequeños. Para conseguir la formación de cristales lo más grandes y puros posible, es necesario controlar la cantidad de núcleos en formación. Si la solución no contiene impurezas ni cristales de su propio tipo, el núcleo sólo puede ser formado por nucleación homogénea. Si algunas partículas extrañas están presentes, la nucleación se facilita y el proceso es conocido como nucleación heterogénea. Ambas nucleaciones, la homogénea y la heterogénea, toman lugar en ausencia de cristales de la propia solución y son colectivamente conocidas como nucleación primaria. La nucleación secundaria se refiere al proceso de formación de cristales que está condicionado y producido por la presencia de partículas de la misma fase en el sistema sobresaturado.
Por otra parte, el proceso de cristalización tiene numerosas aplicaciones industriales y no siempre la obtención de unos cristales puros es el objetivo principal de este proceso. A menudo se da el caso que interesa el proceso de cristalización como integrante en un tratamiento más amplio de efluentes líquidos. En este caso, el objetivo principal es la separación de la contaminación presente en un efluente del propio solvente, de forma que se obtenga el solvente puro y la contaminación en forma sólida, para facilitar su gestión de forma económica. Por ejemplo, esta aplicación de la cristalización es indispensable en los procesos de vertido cero, en los que el efluente se separa en dos corrientes, la del solvente relativamente puro y apto para su reutilización, y la de la contaminación en estado sólido o semi-sólido.
Así pues, la cristalización también se presenta como una excelente solución en aquellos casos en los que el objetivo principal no es la obtención de un producto sólido de elevada pureza, como ocurre en las siguientes aplicaciones:
- Tratamiento de efluentes con una elevada carga contaminante
- Tratamiento de efluentes cuando las técnicas convencionales no son efectivas (como en el caso de las salmueras)
- Imposibilidad de poder verter los efluentes tratados
- Tratamiento de efluentes cuya composición fluctúa y es muy variable
Actualmente, se puede disponer de cristalizadores para el tratamiento de aguas con sales que son muy competitivos en cuanto a eficiencia energética, al basarse en una evaporación al vacío por bomba de calor, y muy robustos en cuanto a su funcionamiento.