CHAPITRES
- Historique
- Bases de départ
- Description du procédé
- Observations sur l’installation
- Domaines d’application du sulfate d’ammonium
- Propriétés physico – chimiques du sulfate d’ammonium
- Conclusions
Historique
De nombreuses industries produisent des effluents qui contiennent des charges potentielles élevées de polluants pour l’environnement. Ces effluents doivent être soumis à des procédés complexes et coûteux, afin de pouvoir les déverser dans des conditions adéquates, conformément à la législation en vigueur (Loi de l’eau). En outre, ils génèrent en général d’importantes quantités de déchets qui doivent être envoyés dans une décharge spécifique, en fonction de leur caractérisation, en ayant pour résultat d’importants coûts d’installations, gestion, réactifs, taxes et impôts correspondant.
Le traitement des déversements séparés apporte une série d’avantages sur le traitement intégré avec les autres effluents. Car, dans de nombreux cas, nous déversons des rinçages qui contiennent des sels ou des restes de procédés qui peuvent être réutilisés, ou qui peuvent servir à obtenir des sous-produits, utiles au sein de l’industrie qui les génère ou en dehors de celle-ci.
La présente étude, donne comme exemple un déversement réel généré par une industrie papetière qui réussit à transformer une partie importante de ses effluents en un produit qui lui est utile et en un sous-produit dont il existe une demande sur le marché. Ainsi, outre d’optimiser ses procédés, elle s’approche davantage au déversement zéro envisagé.
Bases de départ
Dans cette industrie susmentionnée, sont générés plusieurs déversements, parmi lesquels : un qui contient un H2SO4 résiduel à 1 – 3 %, un autre déversement riche en NH3 (5%) et un déversement de NaOH avec une concentration de l’ordre de 1%. En outre, il existe d’autres effluents provenant des nettoyages des circuits et des procédés, avec une charge organique élevée qui sont soumis à l’oxydation.
D’un autre côté, cette industrie consomme du (NH4)2SO4 et elle se trouve dans un environnement agricole riche qui demande des fertilisants. Dans cette démarche, plusieurs tests en laboratoire ont été faits avec différents effluents de l’usine et après avoir séparé les H2SO4 les plus propres, ceux qui contenaient du NH3 et les plus alcalins (riches en NaOH), on projeta et développa un système de séparation du (NH4)2SO4.
Description du procédé
Dans une première phase, on mit en place une installation destinée à former un produit à 2 – 3 % de concentration en poids, d’aspect liquide visqueux qui était obtenu en faisant réagir l’H2SO4 et le NH3 dans un réservoir
2 NH3 + H2SO4 ↔ (NH4)2 SO4
Le débit du déversement acide récupéré a été de 2 m3/h avec une concentration moyenne de 2%. Ce qui représentait un apport de 40 Kg /h de H2SO4, qui équivaut à 40/98 = 0,41 kmole de H2SO4. Comme les réactions sont vérifiées mole par mole, la quantité de NH3 nécessaire serait de 2 x 0,41 x 17 = 13,94 Kg, qui en étant dilué à 5 %, aurait un débit de : 13,94/0,05 = 0,28 m3/h d’effluent ammoniacal, environ.
La solution ammoniacale avait un pH de 9,5 – 10, et afin de pouvoir séparer une partie significative du NH3 gazeux, il faut augmenter le pH jusqu’à 12,5 – 13, ce qui a été obtenu avec le déversement de NaOH qui a un pH 14 à une concentration de 1 % (env. 10 Kg/m3 de NaOH). Ainsi, avec un débit d’environ 1,5 m3/h de ce déversement, nous nous rapprochons de la valeur du pH 13, souhaitée.
D’après ce bilan, la quantité de (NH4)2SO4 produite serait de 0,41 x 132 = 54,12 Kg/h, qui à un débit de 2,015 m3/h, a une concentration de ce produit d’environ 2,68 %, (54,12 /2015).
Comme on peut l’observer dans le diagramme en annexe, on prévoit des réservoirs pour l’effluent ammoniacal, l’effluent acide et alcalin.
Le déversement alcalin est apporté au réservoir des déversements ammoniacaux, afin d’obtenir un pH 12,5- 13, ce qui est obtenu par pompage, avec un système d’agitation et un pH-mètre. À l’intérieur du réservoir on augmente la température jusqu’à 40º C, afin de faciliter la désorption du NH3. À partir de là, on le pompe jusqu’à une tour de stripping qui contient un garnissage à haute surface, à travers lequel circule à contre-courant la solution ammoniacale alcaline, et le flux d’air provenant d’un ventilateur électronique qui dispose d’une résistance électrique pour son réchauffement. Ce qui facilitera la séparation du NH3 qui en découle. La solution est recirculée avec une pompe jusqu’à la zone supérieure de la tour.
Le NH3 est entraîné par l’air de la zone supérieure de la colonne de désorption, jusqu’à la zone inférieure de la colonne d’absorption annexe, où est apporté l’effluent de H2SO4, à travers un groupe de pompage qui aspire l’effluent acide du réservoir. Pour faciliter l’absorption, le liquide contenu dans le réservoir, disposé sous la tour d’absorption, est refroidi jusqu’à une température d’environ 5º C, à travers un refroidisseur. À partir du réservoir, un groupe de pompage l’aspire et recircule la solution acide sur la zone supérieure de la tour d’absorption à contre-courant, avec le gaz qui monte à travers le garnissage contenu dans celle-ci.
L’excédent de gaz peut retourner vers la tour de désorption initiale, avec un autre ventilateur électronique, afin de récupérer éventuellement le NH3 résiduel. Le gaz restant est envoyé à l’extérieur après son traitement à travers le filtre approprié.
L’effluent alcalin dont on a déjà extrait la plus grande partie du NH3, est envoyé vers une station d’épuration des déversements.
Dans une deuxième phase, et en songeant à obtenir un produit plus concentré et commercialisable, on a réalisé le traitement dans un cristalliseur qui permettait d’obtenir un produit de bonne qualité.
Observations sur l’installation
Les matériels doivent être résistants à la corrosion et à l’abrasion. On recommande des PEHD ou PRFV avec un film intérieur en vinyle ester, pour les colonnes. Il faut éviter les éléments métalliques dans les tours, les pompes et surtout dans le circuit acide. Il est recommandé que les pompes soient de type à entraînement magnétique et construites en PP. La roue des pompes a tendance à souffrir de l’usure due à l’abrasion. Pour le cristalliseur, on opte pour un acier inox à haute résistance à la corrosion comme le 316L ou le 904 L.
Lors de l’arrêt de l’installation, il faudra empêcher la cristallisation des sels dans le garnissage et dans le réservoir et les circuits du produit concentré. C’est pourquoi on recommande de la maintenir en recirculation.
Le garnissage des tours (notamment celui de la tour d’absorption), doit être facilement démontable afin de faciliter le nettoyage.
Domaines d’application du sulfate d’ammonium
4.1 Utilisation en agriculture
Le (NH4)2SO4 est un produit applicable directement à l’utilisation agricole ; excellent fertilisant de « démarrage » ou de « fond » au moment des semis. C’est un produit adapté pour tout type de sols et de cultures ; à libération contrôlée (action immédiate et effet prolongé) avec de bonnes qualités de stockage. Comme c’est un fertilisant avec de l’azote et du soufre en plus grande concentration, le calcium modifie légèrement le PH du sol dans la zone d’application, en tirant ainsi un meilleur profit du calcium dans la culture. Sa fluidité et stabilité chimiques sont excellentes, ce qui facilite l’élaboration de formules fertilisantes dans des mélanges physiques et son application manuelle ou mécanique.
L’azote et le phosphore ont une influence sur la croissance et le développement du feuillage, des racines et des tiges des plantes, ainsi que le développement optimum des microorganismes ; le soufre fait partie des acides aminés soufrés qui se trouvent dans les protéines.
Le calcium a une influence sur la qualité du produit et la résistance des fruits ou face aux dommages dus aux nuisibles. Le sulfate d’ammonium granulaire ne se perd pas par lixiviation à cause de l’absorption de l’ammonium par les colloïdes du sol et sa dégradation contrôlée.
4.2 Utilisation industrielle
Le (NH4)2SO4 est un produit très demandé dans le secteur industriel. Il est présent dans les adhésifs, les plastiques, les résines, les teintures, les produits pharmaceutiques et les finitions pour les produits textiles, le papier et les métaux, l’industrie de la panification. Il se mélange à l’alimentation de l’élevage. Il s’utilise également dans la production de cosmétiques et de peintures. Et il est également utilisé pour l’élaboration de produits pharmaceutiques.

Propriétés physico – chimiques du sulfate d’ammonium
Propriétés physiques
À l’état pur ce sont des cristaux blancs sous forme de losanges (Plaques,
agglomérés), mais à l’état commercial d’engrais ils présentent un léger ton jaune à cause du Sulfure d’Arsenic (provenant de cokeries).
Densité : À l’état pur elle est de 1,77, mais le sulfate d’ammonium agricole présente une densité apparente, sans battance, de 0,8 à 1,1.
Solubilité : Dans l’eau elle est très grande et elle augmente considérablement avec la température. La solubilité en kg de sulfate d’ammonium par litre d’eau est de : à 0º C, de 70,6 ; à 20º C, de 7,4 ; à 60º C, de 88,0 et à 100º C, de 103,3.
Humidité hygroscopique : propre au sulfate d’ammonium, elle n’est pas très élevée, lorsque l’humidité atmosphérique critique est de 70%, mais elle peut augmenter s’il existe de l’acide sulfurique libre, dont la soif en eau est très grande. Taux d’humidité hygroscopique à 30º C = 20.
Point de fusion : 280 ºC
Pression de vapeur : 1,871 KPa à 20º C
Réaction de l’engrais : Acide. Taux d’acidification = 110
Salinité : Taux de salinité = 69.
Propriétés chimiques
C’est le résultat de l’action d’un acide fort (sulfurique) sur une base faible (ammoniac). Ceci explique que ses solutions soient partiellement hydrolysées et aient une réaction légèrement acide. Pour le même motif, l’ébullition leur permet de se défaire de l’ammoniac. Le sulfate d’ammoniac peut provoquer des mélanges explosifs, avec des oxydants forts, comme les chlorates.
À température élevée, une perte de NH3 se produit. Il se décompose facilement à température normale, avec les produits alcalins, en produisant un détachement de l’ammoniac.
Produits commerciaux
Le sulfate d’ammonium agricole se présente commercialement sous la forme de :
Sulfate de synthèse, à 21% de N
Sulfate de récupération : avec 20,5 à 20,8% de N
Fiche technique du produit
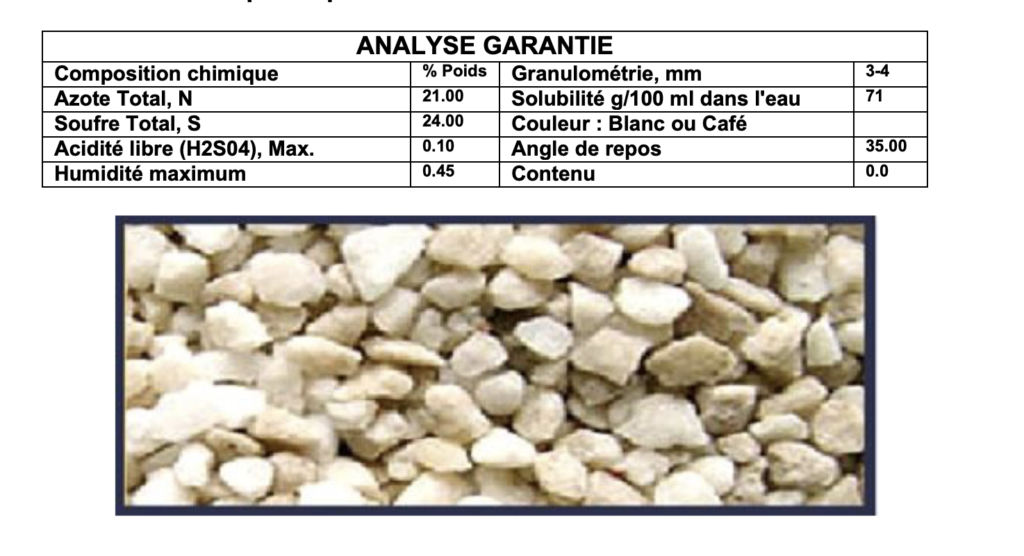
Conclusions
Bien que cela semble être une vérité de la Palice, il n’y a pas d’effluent mieux traité, ni qui nuise moins à l’environnement que celui qui n’est jamais déversé. En outre, de nombreuses fois, certains déversements peuvent beaucoup affecter l’effluent général de l’usine, même s’ils ne représentent qu’un petit volume. Car leur concentration, toxicité ou charge polluante peuvent être proportionnellement élevées face aux autres effluents à épurer. Dans ces cas, il faudra les séparer et les traiter à part ou bien les envoyer à un centre de traitement. Dans tous les cas, il faudra réduire leur volume afin de minimiser, le coût de transport, voire même arriver à les évacuer avec un déchet solide. Ce qui s’obtient à travers des moyens mécaniques ( filtres presse, centrifuges, filtres bande… etc.) ou par évaporation à faible consommation (évaporateurs à vide, thermocompression… etc.) Bien que ces procédés soient coûteux, ils sont habituellement amortis à moyen terme. Car un centre d’épuration général de l’usine pourra être plus simple, et ses coûts d’installation et d’exploitation également inférieurs et, le plus important : le risque de pollution environnementale sera minimisé.
Y-a-t-il une meilleure solution pour réussir à revaloriser ces effluents ? Ceci réduit d’une manière très importante le délai d’amortissement de l’investissement – exploitation. Le cas envisagé dans cet article est un exemple clair de cela.
Bibliographie
- Manuel de l’ingénieur chimique (tome I) 6e édition
- Éléments d’ingénierie chimique (Vian Ocón)
- https://quimica.laguia2000.com/general/sulfato-de-amonio (Sept. 2010)
- Bibliothèque universitaire – Université d’Oviedo.