La pollution atmosphérique constitue une grave menace pour la santé dans la plupart des zones de la planète. Selon une évaluation de la charge de morbidité due à la pollution environnementale réalisée par l’OMS, chaque année, plus de 7 millions de décès prématurés sont attribuables aux effets de la pollution urbaine. De plus, ce n’est pas un problème exclusif des pays les plus développés, mais plus de la moitié de cette charge pèse sur la population des pays en développement.
Les oxydes d’azote ne sont pas les seuls responsables de la pollution atmosphérique, mais ils sont parmi les principaux polluants en importance.
Les oxydes d’azote sont deux gaz d’azote différents : le monoxyde d’azote (NO) et le dioxyde d’azote (NO2). Le terme NOx fait référence à la combinaison des gaz en raison des facilités d’interconversion mutuelle qu’ils présentent en présence d’oxygène. Bien que d’un point de vue formel, le terme général des oxydes d’azote englobe les composés suivants :
- NO
- NO2
- N2O2
- N2O4
- N2O
- N2O3
- N2O5
- NO3 (ce dernier étant instable)
Bien qu’une grande partie des NOx soit d’origine naturelle, une fraction importante des NOx est due à des processus anthropiques. Les sources artificielles les plus importantes correspondent au transport (70 %) et à l’industrie (25 %). Les processus industriels qui génèrent le plus de NOx sont ceux dédiés à la production d’énergie, à la combustion de charbon, de pétrole ou de gaz naturel, ainsi que les processus de galvanoplastie et de gravure des métaux. Le NO et le NO2 se forment dans les processus où, en présence d’azote et d’oxygène de l’air, des températures supérieures à 1200 ºC sont atteintes.
Les oxydes d’azote ont tous en commun d’être des gaz polluants, ce qui fait que leurs émissions ont une incidence particulière sur l’environnement. Les principaux effets qu’ils causent sont :
- La destruction de l’ozone stratosphérique
- Contribution à l’effet de serre
- La production de pluie acide
- La génération de smog photochimique
Pour toutes ces raisons, il est totalement nécessaire, en premier lieu, de minimiser leur production. Et, par la suite, d’éliminer les oxydes d’azote dont la génération n’a pas pu être prévenue. L’objectif de minimiser leur génération peut être atteint en suivant trois stratégies différentes :
- Réduire la température de fonctionnement
- Réduire le temps de résidence des gaz, en particulier de l’azote, dans la zone de combustion, où des températures élevées existent
- Diminuer le rapport oxygène-combustible. En réduisant l’excès d’oxygène, on diminue considérablement la génération de NOx
Cependant, il est impossible d’éviter complètement la génération d’oxydes d’azote et pour se conformer à la réglementation, qui devient de plus en plus exigeante, il faut utiliser des techniques permettant d’éliminer les NOx générés. Les techniques les plus utilisées à cet effet sont :
Absorption par réaction chimique
Cette technique consiste en l’absorption des NOx par une réaction chimique en phase liquide. Le réactif le plus utilisé pour leur absorption est l’acide sulfurique. Celui-ci réagit avec les oxydes d’azote pour former l’espèce HSO4NO (acide nitrosylsulfurique), qui reste en phase liquide. Dans des conditions de haute pression (2 atm) et de basse température (35 ºC), les NOx sont absorbés dans la phase liquide. En revanche, le processus peut être inversé à haute température (180 ºC) et basse pression (0,5 atm) ; dans ces conditions, la molécule azotée (devenue acide nitrique par la présence d’eau) se sépare de l’acide sulfurique, qui peut être réutilisé.
Ce processus présente l’inconvénient de devoir manipuler des réactifs chimiques corrosifs et dangereux tout en nécessitant un espace physique pour abriter le processus. Les efficacités obtenues ne sont pas élevées, ce qui rend la technique recommandable pour de faibles charges de NOx.
Réduction par réaction sélective non catalytique (SNCR)
Cette technique permet la réduction des émissions d’oxydes d’azote par leur conversion en azote gazeux via une pour les cas où les émissions d’oxydes d’azote sont faibles.
Réduction par réaction chimique catalytique sélective (SCR)
Cette technique repose sur un Directive 96/82/CE (Directive Seveso II) et doivent être effectués selon un protocole de sécurité strict, en raison du risque que représente sa grande corrosivité et son caractère explosif en présence d’oxygène.
Au niveau de l’exploitation, plus le rapport NH3/NOx alimenté est élevé, plus l’efficacité obtenue sera grande. Cependant, cela augmentera également la quantité d’ammoniac non réagi qui est gaspillée dans le courant de gaz. Cette perte d’ammoniac non réagi doit être minimisée, car celui-ci réagit en présence d’eau avec le SO3, pour produire du bisulfate d’ammonium (NH4HSO4), qui est corrosif et entraîne l’encrassement des installations. La clé d’une opération optimale est l’alimentation en ammoniac de manière à obtenir un bon rendement tout en minimisant la quantité d’ammoniac non réagi.
Le choix du catalyseur est déterminant dans le processus, car il influence des paramètres clés tels que la température de fonctionnement et l’ampleur de la réaction. Il existe quatre matériaux différents utilisés comme catalyseurs :
- Oxydes métalliques (de vanadium, tungstène, molybdène ou chrome) sur base de dioxyde de titane (TiO2)
- Zeolites
- Oxydes de fer enveloppés d’une fine couche de phosphate de fer
- Carbone actif
Le choix du catalyseur conditionne également directement les coûts d’exploitation, car tous n’ont pas les mêmes propriétés, coûts et durées de vie.
Les principales avantages de la technologie SCR reposent sur le rendement d’élimination des NOx, qui est très élevé, en plus du fait que les NOx sont transformés en azote gazeux sans produire de sous-produit ni de déchet.
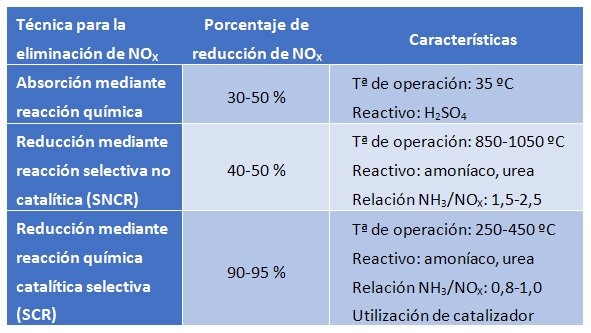
Ainsi, l’émission d’oxydes d’azote doit être contrôlée car elle est strictement réglementée par la législation en vigueur. La première étape pour son contrôle est la minimisation de la production de ces gaz. La production qui ne peut être prévenue devra être correctement traitée avant de libérer le reste des gaz dans l’atmosphère. Pour l’élimination des NOX, la technique la plus efficace est la réduction par réaction chimique catalytique sélective (SCR).
L’urée
Comme nous l’avons mentionné, l’urée est utilisée comme agent réducteur pour éliminer les oxydes d’azote (NOx) par le biais de SCR et SNCR, cette illustration* montre l’aspect d’une molécule d’urée. L’urée est également utilisée comme additif dans les véhicules à moteur à combustion pour neutraliser autant que possible leurs propres émissions. *(crédit 3dchem.com)