La contaminación atmosférica constituye una grave amenaza para la salud en la mayoría de zonas del planeta. De acuerdo con una evaluación de la carga de morbilidad debida a la contaminación ambiental realizada por la OMS, cada año se producen más de 7 millones de muertes prematuras atribuibles a los efectos de la contaminación urbana. Además, no es un problema exclusivo de los países más desarrollados, si no que más de la mitad de dicha carga recae sobre la población de los países en desarrollo.
Los óxidos de nitrógeno no son los únicos causantes de la contaminación atmosférica, pero sí son de los principales contaminantes en importancia.
Los óxidos de nitrógeno son dos gases de nitrógeno diferentes: óxido nítrico (NO) y dióxido de nitrógeno (NO2). El término NOX hace referencia a la combinación de los gases debido a las facilidades de interconversión mutua que presentan en presencia de oxígeno. Aunque desde un punto formal, el término general de los óxidos de nitrógeno, engloba los siguientes compuestos:
- NO
- NO2
- N2O2
- N2O4
- N2O
- N2O3
- N2O5
- NO3 (siendo éste último inestable)
Aunque gran parte de los NOX son de origen natural, una importante fracción de NOX se debe a procesos antropogénicos. Las fuentes artificiales más importantes corresponden al transporte (70%) y a la industria (25%). Los procesos industriales que generan NOX en mayor cantidad son los dedicados a la producción de energía, a la combustión de carbón, petróleo o gas natural y los procesos de galvanoplastia y grabado de metales. El NO y el NO2 se forman en los procesos en los que, en presencia de nitrógeno y oxígeno del aire, se alcanzan temperaturas superiores a les 1200 ºC.
Los óxidos de nitrógeno tienen todos en común que son gases contaminantes, por lo que sus emisiones tienen especial incidencia sobre el medio ambiente. Los principales efectos que causan son:
- La destrucción del ozono estratosférico
- Contribución al efecto invernadero
- La producción de lluvia ácida
- La generación de Smog fotoquímico
Por todo ello, es totalmente necesario, en primer término, minimizar su producción. Y, posteriormente, eliminar los óxidos de nitrógeno que su generación no se ha podido prevenir. El objetivo de minimizar su generación puede ser alcanzado siguiendo tres estrategias diferentes:
- Reduciendo la temperatura de operación
- Reduciendo el tiempo de residencia de los gases, especialmente el nitrógeno, en la zona de combustión, donde existen elevadas temperaturas
- Disminuyendo la relación oxígeno-combustible. Al reducir el exceso de oxígeno, se disminuye considerablemente la generación de NOX
- Óxidos metálicos (de vanadio, tungsteno, molibdeno o cromo) sobre base de dióxido de titanio (TiO2)
- Zeolitas
- Óxidos de hierro envueltos por una fina capa de fosfato de hierro
- Carbono activo
No obstante, es imposible evitar completamente la generación de óxidos de nitrógeno y para cumplir con la normativa, que cada vez es más exigente, se deben utilizar técnicas que permitan eliminar los NOX generados. Las técnicas más utilizadas para este propósito son:
Absorción mediante reacción química
Esta técnica consiste en la absorción de los NOX mediante una reacción química en fase líquida. El reactivo mayormente utilizado para su absorción es el ácido sulfúrico. Éste reacciona con los óxidos de nitrógeno para formar la especie HSO4NO (ácido nitrosilsulfúrico), la cual permanece en la fase líquida. En condiciones de elevada presión (2 atm) y baja temperatura (35 ºC) los NOX quedan absorbidos en la fase líquida. En cambio, se puede revertir el proceso a elevada temperatura (180ºC) y baja presión (0,5 atm); en estas condiciones, se separa la molécula nitrogenada (ahora ácido nítrico por la presencia del agua) del ácido sulfúrico, el cual se puede reutilizar.
Este proceso presenta la desventaja de que se deben manipular reactivos químicos corrosivos y peligrosos a la vez que se requiere espacio físico para albergar el proceso. Las eficacias conseguidas no son elevadas, por lo que la técnica es recomendable para bajas cargas de NOX.
Reducción mediante reacción selectiva no catalítica (SNCR)
Esta técnica permite la reducción de emisiones de óxidos de nitrógeno mediante su conversión en nitrógeno gas vía una reacción química no catalítica. Para llevar a cabo esta conversión, sin la presencia de ningún catalizador, es necesario subir la temperatura dentro del rango 850-1100 ºC. La temperatura de operación depende directamente del agente reductor que se utilice, siendo los más utilizados amoníaco o urea.
Esta técnica se suele utilizar en pequeñas calderas industriales, ya que en instalaciones de mayor tamaño se disparan los costes de trabajar en este rango de temperaturas. El equipo de SNCR no requiere un gran espacio y es de fácil instalación y operación. No obstante, la eficiencia de reducción que se alcanza es moderada, hecho que hace que sea una técnica válida para aquellos casos en que las emisiones de óxidos de nitrógeno sean bajas.
Reducción mediante reacción química catalítica selectiva (SCR)
Esta técnica se basa en un proceso catalítico en el que se reducen de forma selectiva los óxidos de nitrógeno en presencia de un catalizador mientras que el agente reductor (amoníaco o urea) se oxida a nitrógeno gas. El hecho de que la reacción se lleve a cabo sobre la superficie del catalizador hace posible que la temperatura necesaria esté comprendida en el rango 250-450 ºC. La temperatura de operación acabará dependiendo de varios factores, siendo el catalizador utilizado uno de los parámetros claves.
El agente reductor, a la práctica, puede ser una disolución acuosa de amoníaco, amoníaco licuado o bien una disolución acuosa de urea. De todas ellas, la utilización de amoníaco licuado es la opción más económica, hecho que se traduce en unos costes de operación inferiores. Pero por otra banda, la manipulación de amoníaco licuado es mucho más compleja, debido a sus características, que el de una solución acuosa de amoníaco o de urea. El uso, almacenamiento y transporte de amoníaco licuado está sujeto a la Directiva 96/82/CE (Directiva Seveso II) y debe ser utilizado siguiendo un estricto protocolo de seguridad, debido al riesgo que supone el hecho de ser muy corrosivo y explosivo en presencia de oxígeno.
A nivel de operación, como mayor sea la relación NH3/NOX alimentada, mayor será la eficiencia conseguida. No obstante, también aumentará la cantidad de amoníaco que no ha reaccionado y que se desaprovecha en la corriente de gases. Esta pérdida de amoníaco sin reaccionar debe ser minimizada, ya que éste reacciona en presencia de agua con el SO3, para producir bisulfato de amonio (NH4HSO4), el cual es corrosivo y produce el ensuciamiento de las instalaciones. La clave de una operación óptima es la alimentación de amoníaco en tal mesura que se consiga un buen rendimiento a la vez que se minimiza la cantidad de amoníaco no reaccionado.
La elección del catalizador es determinante en el proceso, ya que influye en parámetros claves como son la temperatura de operación y la extensión de la reacción. Existen cuatro materiales diferentes utilizados como catalizadores:
La elección del catalizador también condiciona directamente los costes de operación, ya que no todos tienen las mismas propiedades, coste y vida útil.
Las principales ventajas de la tecnología SCR se basan en el rendimiento de eliminación de NOX, que es muy elevado, además de que se transforman los NOX en nitrógeno gas sin producir ningún subproducto ni residuo.
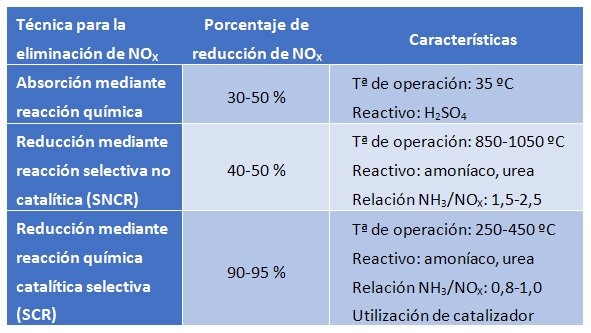
Así pues, la emisión de óxidos de nitrógeno debe ser controlada al estar estrictamente regulada por la normativa vigente. El primer paso para su control es la minimización de la producción de estos gases. La producción que no se pueda prevenir, deberá ser correctamente tratada antes de liberar el resto de gases a la atmósfera. Para la eliminación de los NOX la técnica más eficiente es la reducción mediante reacción química catalítica selectiva (SCR).
La urea
Tal como hemos comentado la urea se utiliza como agente reductor para eliminar los óxidos de nitrógeno (NOx) mediante SCR y SNCR, esta ilustración* muestra el aspecto de una molécula de urea. La urea se utiliza también como aditivo en vehículos con motor de combustión para neutralizar en la medida de lo posible sus propias emisiones.
*(crédito 3dchem.com)