Qu’est-ce que la cristallisation ?
La cristallisation est une méthode de séparation dans laquelle un solide (cristal ou précipité) se forme à partir d’une phase homogène, liquide ou gazeuse. Le solide obtenu peut être très pur, c’est pourquoi la cristallisation est utilisée au niveau industriel comme procédé de purification. D’autre part, la cristallisation de l’eau contenant des sels, ou le traitement des saumures, est une application très courante dans les procédés industriels qui génèrent des eaux usées.

Pour que la cristallisation ait lieu, il est essentiel que la solution soit sursaturée. Les procédés de cristallisation diffèrent les uns des autres par la méthode utilisée pour obtenir la sursaturation. En général, il existe trois principaux moyens :
- Sursaturation produite par refroidissement de la solution avec évaporation négligeable.
- Sursaturation produite par évaporation du solvant avec peu de refroidissement.
- Évaporation par combinaison de refroidissement et d’évaporation dans des évaporateurs adiabatiques (cristalliseurs sous vide).
Il convient de noter que pour utiliser les cristalliseurs dans lesquels la sursaturation est obtenue par refroidissement, les solutés doivent présenter une courbe de solubilité qui diminue significativement avec la température. Dans les cas où la solubilité dépend peu de la température, la sursaturation est obtenue en évaporant le solvant. Et lorsque l’on combine refroidissement et évaporation, une solution est soumise à des conditions de vide afin que le solvant s’évapore soudainement et que la solution se refroidisse de manière adiabatique.
Cette dernière méthode est la plus couramment utilisée dans l’industrie pour provoquer la sursaturation. En pratique, il existe une grande variété de cristalliseurs industriels, chacun conçu spécifiquement pour atteindre de manière optimale la sursaturation de la solution en fonction de ses caractéristiques et propriétés.
Comment fonctionne le processus de cristallisation ?
Le processus de cristallisation n’est pas simple, et l’étape la plus importante consiste à former des cristaux solides au sein de la solution liquide. La solution est concentrée et refroidie jusqu’à ce que la concentration du soluté soit supérieure à la solubilité à cette température, et le soluté forme des cristaux presque purs.
La vitesse de croissance d’un cristal est appelée vitesse de cristallisation. La croissance commence d’abord par la formation du noyau, puis se poursuit progressivement. Lorsque la concentration dépasse la sursaturation, la nucléation – formation de noyaux – se produit naturellement, spontanément et rapidement. La vitesse de cristallisation peut être exprimée par l’équation empirique suivante :
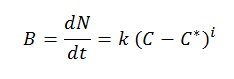
Où :
- B : vitesse de nucléation (noyaux formés par unité de temps et de volume de solvant)
- N : nombre de noyaux formés par unité de volume de solvant
- t : temps
- k, i : paramètres empiriques
- (C-C*) : sursaturation
- C : concentration du soluté dans la solution
- C* : concentration de saturation du soluté
D’après l’équation, la vitesse de nucléation dépend directement de la sursaturation. Il a été démontré que lorsque la sursaturation est élevée, la vitesse de nucléation – et aussi la vitesse de croissance du cristal – sont élevées, ce qui conduit à de petits cristaux imparfaits et contenant des impuretés. À l’inverse, lorsque la sursaturation est faible, la vitesse de formation est réduite, la croissance des cristaux est régulière, et l’on obtient de grands cristaux d’une grande pureté.

La cristallisation comprend principalement deux étapes : la nucléation et la croissance des cristaux. Les deux processus se produisent, si les conditions sont favorables, dans la zone sursaturée du graphique. Cependant, la nucléation exige plus de sursaturation que la croissance. La zone de formation nucléaire où se produit la sursaturation est appelée zone instable, tandis que la zone de croissance est connue sous le nom de zone métastable. Pour que la nucléation ait lieu, la solution doit atteindre la zone instable. Toutefois, une fois là, les noyaux croissent trop rapidement et les cristaux obtenus sont nombreux et très petits. Pour obtenir les plus grands cristaux possibles, purs et réguliers, il est nécessaire de contrôler le nombre de noyaux en formation. Si la solution ne contient pas d’impuretés ni de cristaux de son propre type, le noyau ne peut se former que par nucléation homogène. Si des particules étrangères sont présentes, la nucléation est facilitée et le processus est connu sous le nom de nucléation hétérogène. La nucléation homogène et hétérogène, qui se produisent en l’absence de cristaux du même type, sont collectivement appelées nucléation primaire. La nucléation secondaire désigne le processus de formation de cristaux qui est conditionné et provoqué par la présence de particules de la même phase dans le système sursaturé.
Applications de la cristallisation
Le processus de cristallisation a de nombreuses applications industrielles, et l’obtention de cristaux purs n’est pas toujours l’objectif. Les cristalliseurs sont souvent utilisés dans le cadre d’un traitement plus large des effluents liquides. Dans ce cas, l’objectif principal est la séparation des contaminants présents dans un effluent du solvant lui-même, afin d’obtenir le solvant pur et de transformer les contaminants en forme solide, ce qui facilite leur gestion économique. Par exemple, cette application de la cristallisation est indispensable dans les procédés de rejet liquide nul (ZLD), dans lesquels l’effluent est séparé en deux flux : l’un de solvant relativement pur, apte à être réutilisé, et l’autre de contaminants sous forme solide ou semi-solide.
Ainsi, la cristallisation s’avère également une excellente solution dans les cas où l’objectif principal n’est pas l’obtention d’un produit solide de haute pureté, comme dans les applications suivantes :
- Traitement d’effluents à forte charge polluante
- Traitement d’effluents lorsque les techniques conventionnelles ne sont pas efficaces (comme dans le cas des saumures)
- Impossibilité de rejeter les effluents traités
- Traitement d’effluents dont la composition fluctue et est très variable
Aujourd’hui, les cristalliseurs pour le traitement des saumures sont très compétitifs en termes d’efficacité énergétique : la consommation d’énergie a été optimisée et réduite, tout en restant une technologie très robuste et fiable dans leur fonctionnement.