SECTIONS
- Introduction
- Processus Pal et Caron
- Processus Sherrit-Gordon
- Processus de chloruration du nickel
- Extraction par formation de chélates
Introduction
Le cobalt et le nickel se trouvent mutuellement associés dans la nature dans un grand nombre de gisements. L’exploitation minière de ces métaux, ainsi que d’autres technologiquement associés aux avancées électroniques et en particulier dans le domaine des batteries, de l’accumulation d’énergie et de la réduction du volume de ces éléments indispensables dans nos mobiles, ordinateurs, véhicules hybrides et véhicules électriques, est en train de se réactiver pour garantir des approvisionnements croissants.
Le prix international du cobalt a explosé de 127 % en 2017, celui du cuivre de 30 %, celui du tungstène de 27 %, le prix du lithium a presque doublé depuis 2015 et à ces indicateurs, il est important d’observer comment certains pays prennent position physiquement dans certains gisements, comme la Chine au Katanga.
Les processus associés à ces traitements extractifs doivent évoluer et, à partir de technologies optimisées, faire face à des gisements avec des teneurs inférieures. Le cobalt et le nickel sont deux éléments qui prennent position dans les nouvelles technologies, en particulier celles ayant un lien énergétique.
Le cobalt fait partie de superalliages d’aciers qui doivent fonctionner à haute température et résister à des processus d’usure par fluage, des aimants (Alnico, Fernico, Cunico..), des émaux, des revêtements, des électrodes, des batteries, des câbles de structure pour pneus.
Les minéraux les plus importants du cobalt sont l’esmaltite CoAs2 et la cobaltite CoAsS, mais d’un point de vue technique, les principales sources de cobalt sont les « speiss ». Ces matériaux sont un mélange d’arséniures contenant des quantités appréciables de nickel, de cobalt, de fer ou d’argent.
Les principales réserves de cobalt se trouvent au Congo, en Russie, au Pérou, au Canada, en Finlande, au Chili, en Birmanie, au Maroc et au Zimbabwe. Normalement, l’arsenic fait également partie des minéraux de constitution. Le traitement initial de ces arséniures se fait par un broyage et un concentré par flottation ou gravité.
Les parties enrichies en nickel, cobalt et souvent aussi en fer, sont mélangées avec du coke métallurgique. Ce coke est obtenu à partir de charbon bitumineux dans des fours avec une atmosphère libre d’oxygène, en retirant le contenu volatile et en obtenant un charbon poreux adapté à ces traitements métallurgiques.
Le mélange de la mine se fait avec de l’oxyde de calcium et de la silice, produisant une scorie. Ce fait permet de séparer l’argent, un mélange de matériaux riches en cuivre, nickel et cobalt, et un résidu scoriable. Ce mélange riche en cuivre, nickel et cobalt est ce qu’on appelle techniquement un « speiss ». Le parcours de ce mélange à l’état pur du métal est un processus complexe.
Le nickel se trouve dans la nature normalement combiné avec l’arsenic, l’antimoine et le soufre sous forme de sulfure. Environ 65 % du nickel est utilisé dans la fabrication d’acier inoxydable austénitique et 21 % dans la fabrication de superalliages.
Le reste est utilisé pour la fabrication d’autres alliages (Alnico, mu-métaux, monel, nitinol) et de catalyseurs. Le Canada, Cuba et la Russie produisent 70 % du nickel dans le monde. La Bolivie, la Colombie et la Nouvelle-Calédonie ont également d’importants gisements.
Les minéraux sources de nickel sont la millérite, NiS, bien qu’il existe également des dépôts de NiSb, NiAs2, NiAsS ou NiSbS et la garnierite Si4O13[Ni, Mg]2•2 H2O.
Les dépôts les plus importants d’un point de vue commercial sont ceux de garnierite, qui est un silicate de magnésium et de nickel de composition variable et combiné avec la pyrrhotite (FenSn+1) qui contient de 3 à 5 % de nickel. On trouve également du nickel provenant de météores allié avec du fer.

PROCESSUS PAL ET CARON
En général, le traitement du nickel repose sur le traitement des sulfures de nickel par une torréfaction à l’air pour obtenir le NiO. Celui-ci est réduit avec du charbon pour obtenir du nickel métallique.
La purification du nickel se fait par le monoxyde de carbone qui se combine avec le nickel impur à 50ºC et pression atmosphérique ou avec le mélange de nickel et de cuivre, dans des conditions plus complexes, obtenant le Ni(CO)4, qui est volatil. Par décomposition thermique à 200ºC, on récupère le nickel pur avec une grande pureté.
Lorsqu’on parle de la métallurgie du nickel et du cobalt, il faut différencier différents types de gisements. Tout d’abord, les gisements latéritiques limonitiques. Ce sont des sols situés dans des régions chaudes qui se caractérisent par une faible concentration de silice et un haut contenu en oxydes.
Ces matériaux sont généralement traités par des méthodes hydrométallurgiques ; processus CARON (lixiviation générée par carbonate d’ammonium) et processus PAL (lixiviation acide à haute pression). Le processus métallurgique PAL implique le préchauffage du minerai et la lixiviation avec de l’acide sulfurique concentré à haute température et pression.
Les espèces chimiques de nickel et de cobalt sont transformées par un processus chimique hydrométallurgique en sels de sulfate solubles, et sont récupérées de la dissolution dans un circuit de décantation à contre-courant (CCD). Le CCD implique de laver le résidu et de récupérer le nickel et le cobalt solubles.
L’acide restant est neutralisé en utilisant une suspension de carbonate de calcium, ce qui produit un précipité de sulfate de calcium. On peut injecter du sulfure d’hydrogène pour précipiter le nickel et d’autres sulfures. À partir de cela, il y a une lixiviation ultérieure pour éliminer le fer et le cuivre, et enfin la précipitation du nickel par l’ajout d’ammoniaque, de sulfate d’ammonium et d’hydrogène.
L’un des processus les plus utilisés pour traiter le « speiss » de nickel et de cobalt est le processus Sherrit-Gordon Mines Ltd. de Fort Saskatchewan Alberta, Canada.
PROCESSUS SHERRIT-GORDON
Les processus de la métallurgie du nickel et du cobalt commencent par le traitement initial du minerai, le reconcentrant par le broyage et la flottation/gravité et obtenant un « speiss », riche en cobalt et en nickel.
Le processus commence par l’introduction du minerai associé essentiellement à du sulfure, dans un réacteur avec de l’acide sulfurique et de l’air sous pression. Dans cette procédure, les sulfures sont éliminés, obtenant du sulfate de nickel (II) et du sulfate de cobalt (II) en solution. Dans cette première étape de dissolution, le sulfure est éliminé.
NiS + 2O2 ⟶ NiSO4
CoS + 2O2 ⟶ CoSO4
Le processus de lixiviation a lieu avec NH3, le pH est ajusté et une première précipitation du fer se produit.
NH3 + H2O ⟶ NH4OH
Fe3+ + OH– ⟶ Fe(OH)3
La précipitation de Fe3+ se produit sous forme de Fe2O3 et de SiO2. Le fer, habituellement associé aux sulfures de cobalt et de nickel, doit être séparé.
En régulant le pH à des valeurs proches de 7, sa déposition se produit. Par la suite, dans les mêmes conditions d’air sous pression et d’ammoniaque, l’oxydation de Co2+ en Co3+ se produit.
Les solutions de cobalt (II) en solution aqueuse et en présence d’ammoniaque s’oxydent facilement en Co (III) avec formation de complexes.
La plupart des agents formateurs de complexes sont des ligands provenant d’acides faibles, c’est-à-dire des bases de Brönsted et donc la valeur du pH est un facteur critique pour la formation et la stabilisation du complexe. La concentration effective de ligand dans la solution, qui est déterminée par le pH, affectera la dissolution du complexe.
En général, à des valeurs de pH élevées, la dissociation du complexe est moindre, car à ces valeurs de pH, le ligand libre prédomine.
Cependant, d’une part, l’oxydation du Co(II) en Co(III) n’est pas facile car les composés de Co(II) sont beaucoup plus stables et d’autre part, les composés de coordination du Co(III) échangent difficilement les ligands contrairement à ceux de Co(II), c’est pourquoi dans la chimie à goutte, qui nécessite un temps et ne peut pas apporter d’énergie calorifique au système, on obtient presque toujours un mélange des deux complexes, ceux de Co(II) et ceux de Co(III).
Pour cette raison, le réacteur est porté à des températures de 80ºC et des pressions d’air de 9 atmosphères. L’explication peut être faite en considérant les données du tableau suivant :
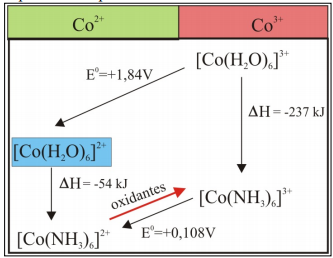
Dans cette partie du processus de lixiviation, l’apport de température est nécessaire pour la formation de [Co(NH3)6]3+.
La formation de Co3+, comme l’indique le diagramme de Pourbaix, est favorisée par des pH basiques et des potentiels supérieurs à 1.2.
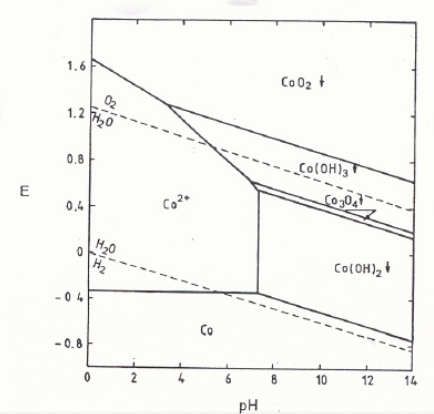
À l’étape suivante, de l’acide sulfurique est ajouté de manière à produire le sulfate de nickel et d’ammonium (NiSO4 (NH4)2SO4·H2O).
Ce sel a une coloration verte et est peu soluble dans l’eau, ce qui favorise la précipitation. À cette étape, on procède à l’évaporation et à la cristallisation de ce sel, de manière répétée pour augmenter la pureté des cristaux.
Ces cristaux de sulfate double de nickel et d’ammonium sont traités avec une solution concentrée de NaOH, de manière à obtenir Ni(OH)2. L’hydroxyde de nickel se dissout avec de l’acide sulfurique et on obtient du sulfate de nickel, qui par électrolyse permet la réduction du Ni2+ en Ni0.
Les solutions de sulfate d’ammonium permettent la récupération de l’ammoniaque par stripping.
Enfin, la solution liquide contenant [Co(NH3)6]3+ est réduite de Co3+ en Co2+, par des poudres de Co0 (cobalt métallique).
Enfin, par hydrogène, la réduction de Co2+ en Co0 se produit, obtenant ainsi de la poudre de cobalt métallique.
Ci-dessous, un diagramme présentant la séquence des différentes opérations du processus Sherrit-Gordon.
PROCESSUS DE CHLORURATION DU NICKEL
Actuellement, les grands minerais de cobalt et de nickel sont en voie d’épuisement et les principaux minerais de ces deux métaux sont constitués de teneurs plus faibles et de concentrations minérales formées par différents métaux. Cela oblige dans chaque cas à modifier les processus extractifs de traitement du minerai.
Dans ce sens, dans le cas de « speiss » de cobalt et de nickel avec une faible teneur, on procède à un traitement en milieu chloré:
Co2+ + Cl2 + ZnO (pH 4 ; régulateur de pH) ⟶ Co3+
Ni2+ + Cl2 + ZnO (pH 4 ; régulateur de pH) ⟶ Ni3+
En contrôlant correctement le pH et le potentiel de réduction, en particulier à pH basique selon le diagramme de distribution des espèces chimiques, le Ni(II) peut être maintenu en solution et le Co(OH)3 peut précipiter.
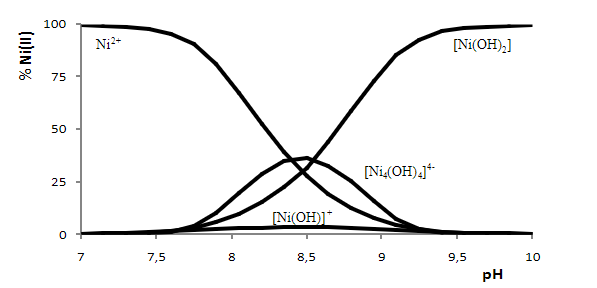
Par calcination, on peut transformer l’hydroxyde de cobalt en oxyde de cobalt. Cet oxyde de cobalt (III) peut être impur avec de l’oxyde de zinc, c’est pourquoi il devra être traité à un pH faiblement acide et séparé convenablement du cobalt. Enfin, l’hydroxyde de cobalt peut être transformé par calcination en oxyde de cobalt (III).
EXTRACTION PAR FORMATION DE CHÉLATES
Un autre des méthodes les plus utilisées pour le traitement des mélanges métalliques concentrés est le traitement avec des agents extractants. Dans ce processus, une solution concentrée par lixiviation acide (acide sulfurique) est traitée pour des espèces comme le nickel, le cuivre et le fer.
Dans un premier temps, on traite la forte concentration d’acide sulfurique avec de l’amine, afin de réduire sa concentration. Dans une seconde phase, on procède à l’ajustement du pH à une valeur entre 3 et 4 qui facilite le précipité de fer. En solution, le cuivre et le nickel sont maintenus.
Par solvant, on extrait le cuivre. Les types de solvant utilisés dans ce processus sont des substances organiques comme les oximes, le diéthylthiocarbamate, les butylacétates, les cétoximas…). Ces solvants forment des chélates avec l’espèce métallique en question, dans ce cas le cuivre, et permettent son passage à la phase organique en formant un composé organométallique.
La phase aqueuse est enrichie en NaCN afin de faciliter la formation de complexes du nickel dans la phase aqueuse et d’accentuer la différence entre les deux phases, de manière à ce que les deux espèces restent stabilisées dans leurs phases respectives.
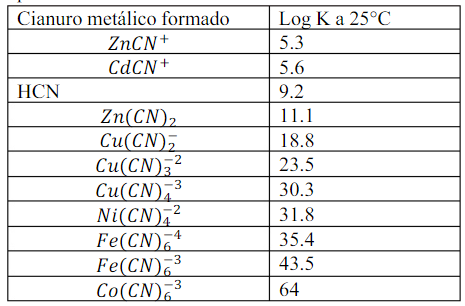
Une fois les solutions de nickel et de cuivre séparées, les métaux peuvent être récupérés par récupération électrolytique.
BIBLIOGRAPHIE
Cheng S., Gattrell M., Guenat T., MacDougall B. L’oxydation électrochimique des solutions de cyanure de cuivre alcalin. Electrochimica Acta 47 (2002) 3245-3256.
Cornwall, H. (1966). Dépôts de nickel en Amérique du Nord. [ebook] Washington : Bureau d’impression du gouvernement des États-Unis. Disponible à : https://pubs.usgs.gov/bul/1223/report.pdf [Consulté le 31 juillet 2017].
Crundwell, F, Moats, M, Ramachandran, V, Robinson, T, & Davenport, WG 2011, Métallurgie extractive du nickel, du cobalt et des métaux du groupe platine, Elsevier Science, Oxford. Disponible sur : ProQuest Ebook Central. [31 juillet 2017].
Kumar, V., Sahu, S. et Pandey, B. (2010). Perspectives pour les processus d’extraction par solvant dans le contexte indien pour la récupération des métaux de base. Une revue. Hydrométallurgie, 103(1-4), pp.45-53.
Jeffrey M.I., Linda L.,. Breuer P.L, Chu C.K. Une étude cinétique et électrochimique du processus de cyanure d’ammoniaque pour l’extraction de l’or dans des solutions contenant du cuivre. Minerals Engineering 15 (2002) 1173–1180
Ones, J. (2017). Poudres de nickel provenant du processus carbonyle. [en ligne] AZoM.com. Disponible à : https://www.azom.com/article.aspx?ArticleID=499 [Consulté le 31 juillet 2017].
« `