Secciones
- Características básicas del litio
- Aplicaciones del litio
- Reciclaje de dispositivos electrónicos con baterías de litio
- Extracción y obtención de litio
- Reciclaje de baterías y recuperación de Litio
- Conclusiones
Características básicas del litio
El litio (Li) es el metal más ligero, su densidad es la mitad de la del agua. Al igual que los demás metales alcalinos es monovalente y muy reactivo, aunque menos que el sodio, por lo que no se encuentra libre en la naturaleza.
Es un elemento moderadamente abundante; está presente en la corteza terrestre en 65 ppm, lo que lo coloca por debajo del Ni, Cu y el W y por encima del Cr y el Sn.
El Li junto al H y el He, es uno de los únicos elementos que se obtuvieron en el Big Bang. Todos los demás se sinterizaron a través de fusiones nucleares en estrellas en la secuencia principal o durante estallidos de supernovas. Tiene las siguientes características físico – químicas básicas:
- Densidad : 535 Kg/m 3
- Dureza Mohs : 0,6
- Apariencia : Sólido blanco plateado , gris
- Masa atómica : 6,941
- Radio atómico : 167 pm
- Estado oxidación : Base fuerte
- Estructura cristalina : Cúbica centrada en el cuerpo
- Punto de fusión : 453,69 K
- Punto de ebullición : 1615 K
- Calor específico : 3582J/(Kg.K)
Aplicaciones del litio
Al litio se lo conoce como el petróleo blanco por el papel protagonista que desempeña y previsiblemente desempeñará en el panorama energético en los próximos años.
Sus propiedades convierten a los iones de litio en los ingredientes perfectos para fabricar baterías. Por su elevado calor específico, se emplea en aplicaciones de
transferencia de calor, y por su elevado potencial electroquímico constituye un ánodo adecuado para las baterías de los coches eléctricos, los smartphones y algunos aparatos
electrónicos.
También se le dan los siguientes usos, aunque su consumo es relativamente pequeño con relación al ya mencionado de las baterías:
- Las sales de litio, particularmente el carbonato de litio (Li2CO3) y el citrato de litio, se emplean en el tratamiento de la manía y la depresión bipolar, aunque últimamente, se ha extendido su uso a la depresión unipolar.Es un estabilizador del estado de ánimo. Se piensa que sus efectos se basan en sus efectos activos sobre la función de la serotonina. Además, se encuentra disuelto en el plasma sanguíneo y/o en los eritrocitos.
- El cloruro y el bromuro de litio tienen una elevada higroscopicidad por lo que son excelentes secantes. El segundo se emplea en bombas de calor de absorción, entre otros compuestos como el nitrato de litio.
- El estearato de litio es un lubricante general en aplicaciones a alta temperatura.
- El litio es un agente empleado en la síntesis de compuestos orgánicos.
- El hidróxido de litio se usa en las naves espaciales y submarinos para depurar el aire extrayendo el dióxido de carbono.
- Es componente común de las aleaciones de aluminio, cadmio, cobre y manganeso empleadas en la construcción aeronáutica, y se ha empleado con éxito en la fabricación de cerámicas y lentes, como la del telescopio de 5,08 m de diámetro de Monte Palomar.
- También tiene aplicaciones nucleares. Los isótopos estables del litio son dos: Li-6 y Li-7, siendo este último el más abundante (92,5%).
Anualmente entran en los mercados de la Unión Europea 800.000 toneladas de baterías de automóviles, 190.000 toneladas de baterías de uso industrial y 160.000 toneladas de baterías de consumo doméstico o ciudadano. En su composición, estas baterías contienen litio y otros metales valiosos como cobalto, cobre, etc.
A nivel mundial, se estima que el mercado de baterías de ion litio generará unos ingresos de 46.210 millones de dólares en 2022. Debido a la tensión creciente oferta-demanda en el mercado, los precios del litio se incrementaron en un 47% en 2016, y se estima que la demanda se incremente en un 64% para 2020.
El problema está en los efectos ambientales de la explotación de este mineral, como la contaminación de agua, impactos en el paisaje, impacto en la flora y fauna, generación de residuos sólidos y químicos… Argentina tiene muy presente estas cuestiones, pues las autoridades han confirmado que el país triplicará la producción de litio para 2019. Se espera que para el 2025 la producción de litio se ubique entre 400.000 y 500.000 toneladas.
Reciclaje de dispositivos electrónicos con baterías de litio
El procesamiento y reciclaje de residuos procedentes de aparatos eléctricos y electrónicos, tales como ordenadores, televisores, neveras y teléfonos móviles, es hoy más importante que nunca por el rápido aumento del consumo de estos productos.
En el reciclaje de baterías de Li, se desecha el propio litio que contienen. Esto puede parecer una incongruencia, pero económicamente no lo es, ya el precio del litio es lo suficientemente bajo como para que no existan muchas iniciativas privadas desarrollando procesos eficientes para su reciclaje.
Actualmente, cuando mandamos nuestras baterías de litio a reciclar, los metales que se extraen de ellas son aquellos más valiosos, como el cobalto. El cobalto se utiliza en las baterías de ion litio, de donde luego se extrae en forma de óxido de cobalto y litio, con un precio de 19 euros por kilo, más de tres veces el precio en el mercado del litio.
Así, el aprovechamiento del litio presente en baterías al final de su vida útil representa una oportunidad con gran potencial, aunque todavía con obstáculos por superar. El reciclaje permite recuperar recursos valiosos y disminuir la necesidad de extraerlos de yacimientos, pero los procesos actuales suelen implicar elevados costes y una eficiencia limitada en la obtención de ciertos metales, lo que compromete su rentabilidad. Aun así, el auge de la movilidad eléctrica y la transición hacia fuentes de energía más limpias están acelerando la innovación en métodos de reciclaje que buscan ser más efectivos y competitivos en el plano económico.
Extracción y obtención de litio
Extracción a partir de minerales
Existen diferentes procedimientos de extracción. Australia, el mayor productor global, lo obtiene a través de la minería convencional a partir de minerales como del espodumeno de Greenbush, pero es un proceso caro y sucio.
Chile, Argentina y China, en cambio, utilizan un lento proceso de evaporación del agua de las salinas. Se extrae de salmueras donde existe en sales naturales como en el Salar de Atacama en Chile o en el del Hombre Muerto y otros en Argentina, o de depósitos.
Gran parte de la producción mundial de litio proviene de estas salmueras, cuyo costo de producción es mucho menor que de los depósitos minerales (según John McNulty: 1.500-2300 $/Tm y 4.200-4.500$/Tm, respectivamente).
Las reservas o los recursos de litio de Bolivia están en salmueras, que tienen una densidad aproximada a 1.200 gramos por litro (g/l), por lo que una concentración de litio de 0,1% en peso equivaldrá a 1.000 partes por millón (ppm) y 1,2g/l.
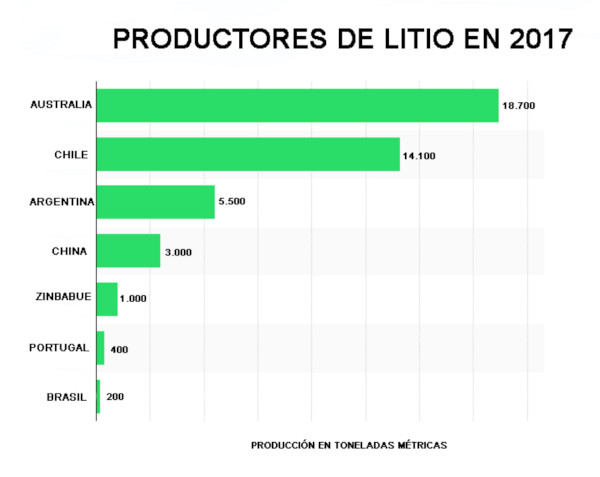
La extracción de salmueras de litio se realiza mediante bombeo y su concentración por medio de la adsorción utilizando un adsorbente selectivo, o por evaporación en piscinas poco profundas construidas para tal efecto. La evaporación además de elevar la concentración de las sales hace que al saturarse algunas de éstas se vayan precipitando.
La adsorción tiene las ventajas de que no es influida por la composición del agua salada (puede tratarse salmueras con bajas concentraciones de litio como experimentalmente se lo hace con el agua de mar), ni por las condiciones meteorológicas del lugar y no se generan muchos residuos y las desventajas que son necesarios reactivos, el equipo de adsorción es caro y complicado y el costo del adsorbente elevado.
Las ventajas de la evaporación natural son básicamente, que no se consume energía ni se utilizan muchos reactivos químicos, mientras que sus desventajas son la necesidad de usar simultáneamente otro método de separación, la acumulación de residuos y la dependencia de las condiciones meteorológicas del lugar (velocidad de evaporación y lluvias).
La mayor producción mundial de litio a partir de las salmueras se obtiene del Salar de Atacama en Chile, donde se utiliza el método de evaporación y del que se tienen datos y muchos factores de operación, que permiten su comparación con los del Salar de Uyuni en Bolivia.
Las salmueras de Atacama son más ricas que las de Uyuni en litio (también en potasio y boro), por lo que la relación Mg/Li, nociva para la concentración del litio es de 6/1 y 19/1 respectivamente.
Mientras que la evaporación y la pluviometría son de 3.200 mm/año y 10-15 mm/año en Atacama, en Uyuni son de 1.500 mm/año y 200-500 mm/año, vale decir que en Uyuni la evaporación es menor y la lluvia mucho mayor, lo que retardará bastante la evaporación.
En Atacama el proceso de evaporación que concentra el litio de 0,15% a 6% (40 veces) dura de 12 a 18 meses; es de prever que en Uyuni este proceso dure mucho más.
El estudio de laboratorio «Tratamiento químico de salmueras del Salar de Uyuni-Potosí» realizado en 1987 en Francia mediante el Convenio UMSA-ORSTOM (Instituto francés de investigación científica para el desarrollo), simulando en 5 vasos las condiciones de las piscinas de evaporación, estableció que precipita primero el cloruro de sodio (NaCl) y casi en seguida el cloruro de potasio (KCl).
Como el cloruro de magnesio (MgCl2) no puede ser separado con la evaporación, lo que complica el proceso, se lo precipita como hidróxido de magnesio (Mg(OH)2) añadiendo cal.
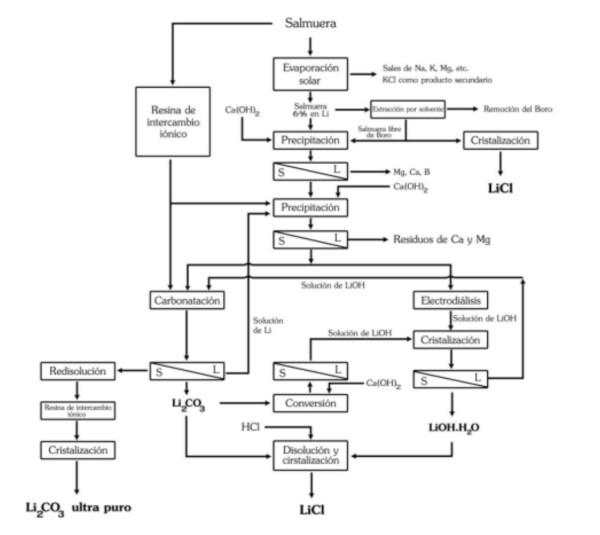
El proceso de obtención del cloruro de litio, a partir del carbonato o de hidróxido de litio, se puede lograr reaccionando con ácido clorhídrico:
Li2CO3 + 2HCl === 2LiCl + H20 + C02
LiOH·H2O + HCl === LiCl + 2H2O
Precipitación y refinado del carbonato de litio (CL)
El Cl obtenido por cualquier método debe ser purificado, secado y cristalizado. A pesar del alto contenido de litio en el Salar de Atacama y la experiencia en su obtención, se indica que su recuperación es del 42%.
El Cl a utilizar en la fabricación de baterías para vehículos eléctricos debe tener una pureza de por lo menos 99,95%, por lo que el Cl obtenido por precipitación debe ser refinado a través de varias reacciones y etapas de recristalización, en algunos casos mediante una resina de intercambio iónico.
Debido a que el proceso de refinación tiene un elevado coste y su recuperación es menor luego de cada etapa (en la etapa de refinación se estima en aproximadamente 70%), cuanto mayor la pureza del CL, su precio se incrementa en mucha mayor proporción.
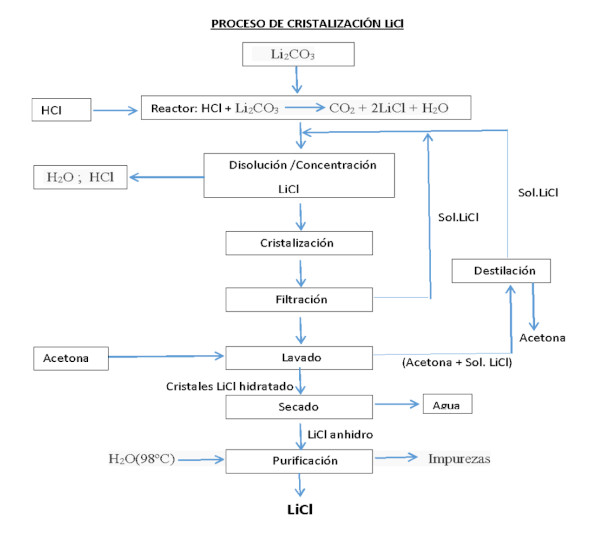
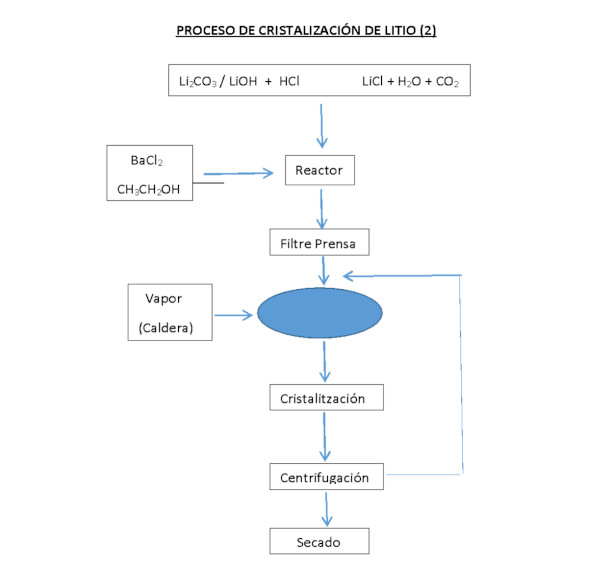
Reciclaje de baterías y recuperación de Litio
Concienciados de la necesidad de reciclar el litio de las baterías usadas y pensando en su futura escasez y ascendiente encarecimiento, se han estudiado algunos procesos que resumimos a continuación:
Proceso Físico – Químico
La recuperación de los materiales que componen las baterías de ion litio se realiza mediante el proceso de Lixiviación. Es decir, a través del uso de ácidos para disolver los componentes de las baterías una vez desmantelado el dispositivo.
El proceso en su totalidad debe seguir una serie de pasos, iniciando por la recolección de baterías, clasificación y descarga de electricidad. Luego, se realiza la separación de sus componentes, hasta lograr obtener el ánodo y el cátodo (partes que permiten la reacción electroquímica) completamente separados.
De esta forma se trabaja cada parte por separado para recuperar las materias primas de la batería.
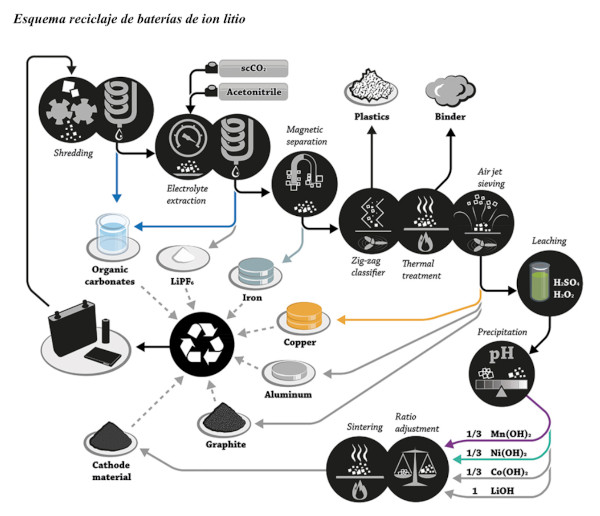
Otro sistema presenta una alternativa para la recuperación de litio, cobalto, manganeso y níquel de las baterías usadas de los teléfonos móviles y los ordenadores.
El proceso se inicia con el desensamble manual de estas para separar el residuo de interés, luego se realiza una reducción de tamaño y se llega entre 560 y 800 μm en el residuo de los aparatos, respectivamente.
El aluminio y el cobre son lixiviados con hidróxido de amonio para eliminar reacciones de interferencia en etapas posteriores. El lavado filtrado proveniente de la etapa anterior se lixivia con ácido sulfúrico, y se obtienen recuperaciones máximas de 96,0 y 99,9 % de litio, cobalto, manganeso, níquel, con concentraciones de 3,0 y 4,0 M, en cada tipo residuo.
El licor ácido lixiviado es neutralizado con hidróxido de sodio, se adiciona bicarbonato de sodio y se precipita carbonato de manganeso, hidróxido de cobalto y bicarbonato de litio, con las respectivas condiciones necesarias.
Luego se procede a la Evapo – cristalización de los productos precipitados y se alcanzan recuperaciones superiores al 96,0 %, en cada metal.
El Carbonato de Litio (Li2CO3) es el compuesto de litio más utilizado; un gramo de litio equivale a 5,32 gramos de carbonato del litio (CL).
Recuperación electroquímica de litio
Recientemente, el investigador argentino Ernesto Calvo propone implementar una innovadora tecnología de extracción de litio a gran escala, sin generar residuos contaminantes.
Para ello, extrae la salmuera mediante un sistema de bombeo para introducirla en un reactor con dos electrodos. Estos atrapan selectivamente, por un lado, los iones de litio, y por el otro, el cloruro de la salmuera, para ser restituido al salar.
Posteriormente, se invierte la polaridad eléctrica del reactor y se hace el proceso inverso, es decir, se saca la salmuera y se incorpora una solución de recuperación que concentra el cloruro de litio.
Para este proceso se utiliza energía solar y el cloruro de litio extraído de la salmuera forma una especie de batería de litio para almacenar energía renovable intermitente.
Membranas de Ósmosis Inversa capaces de separar el litio
Recientemente se ha desarrollado una nueva tecnología que permitirá sacar litio del agua del mar, y además hacerlo de una forma eficiente, también produciendo agua potable en el proceso.
Como sabemos, el agua de mar es un cóctel complejo de minerales útiles, pero es difícil separar los que necesitamos, como el litio. Un equipo de científicos de Australia y Estados Unidos han desarrollado una nueva técnica de desalinización de agua que no solo puede hacer que el agua de mar sea potable, sino que recupera el litio presente en la misma.
La clave del proceso son las estructuras metal-orgánicas (MOF), que cuentan con la mayor área de superficie interna de cualquier material conocido. Un solo gramo teóricamente podría cubrir un campo de fútbol, y es esta intrincada estructura interna la que hace que sean perfectos para capturar, almacenar y liberar moléculas.
Actualmente, las membranas de ósmosis inversa son la tecnología más utilizada para la filtración de agua, y funcionan de una forma bastante simple. Los poros de la membrana son lo suficientemente grandes como para que pasen las moléculas de agua, pero son demasiado pequeños para la mayoría de los contaminantes.
El problema es que, para trabajar, estos sistemas requieren bombear agua a una presión relativamente alta.
Las membranas MOF, por otro lado, pueden ser más selectivas y eficientes.
Investigadores de la Universidad de Monash, la Organización de Investigación Científica e Industrial de la Commonwealth y la Universidad de Texas, han desarrollado una membrana de este tipo.
El diseño se inspiró en la «selectividad iónica» de las membranas celulares biológicas, lo que permite que el material MOF deshidrate iones específicos a medida que pasan. Mejor aún, estos filtros no requieren que se forme agua, lo que también ahorra energía.
«Podemos usar nuestros hallazgos para abordar los desafíos de la desalinización del agua», dice Huanting Wang, autor del nuevo estudio. En lugar de confiar en los procesos caros y con gran consumo energéticos actuales, esta investigación abre la puerta para eliminar los iones de sal del agua de una manera mucho más eficiente en términos de energía y ambientalmente sostenible.
Estos iones de litio son abundantes en el agua de mar ( aprox. 0,17 ppm), por lo que el desarrollo de esta tecnología podría tener grandes repercusiones para la industria minera que actualmente utiliza tratamientos químicos y poco eficientes para extraer el Litio de rocas y salmueras.
La demanda global de litio requerida para sectores como el coche eléctrico es cada vez más alta, por lo que estas membranas se posicionan como una alternativa eficiente de extraer el propio litio del agua del mar, que es un recurso abundante y de fácil acceso, por lo que su explotación debería ser además económica.
En esta aplicación podemos pensar en una osmosis Inversa de tipo de cerrado a fin de maximizar la concentración del litio y así reducir el tamaño y el coste del posterior sistema de Evapo – Cristalización necesario.
Recuperación selectiva evaporativa de litio (LiOH)
La recuperación selectiva de litio a partir de salmueras con un contenido menor al 1% en presencia de altas concentraciones de otros iones alcalinos y alcalinotérreos es un objetivo industrial.
Los procesos evaporativos se basan en solubilidad diferencial de sales de litio en soluciones concentradas de las salmueras, o sea recristalización fraccionada.
Alternativamente se han diseñado procesos químicos y electroquímicos selectivos a la recuperación de cloruro, hidróxido o carbonato de litio de alta pureza que buscan reducir los tiempos de proceso y disminuir el impacto ambiental por pérdida de agua y formación de residuos ambientalmente nocivos.
Recientemente se ha propuesto un método rápido basado en la precipitación de fosfato de litio, Li 3 PO 4 poco soluble (0,39 g/l) por tratamiento de salmueras con ácido fosfórico; luego se trata el fosfato de litio insoluble con cal para formar hidroxiapatita muy insoluble y recuperar hidróxido de litio soluble.
3Li3PO4 + 5Ca(OH)2 → Ca5(PO4)3.OH + 9LiOH
Procesos de extracción de litio de sus depósitos en salares Argentinos. En este proceso el ácido fosfórico se recupera por tratamiento de la hidroxiapatita con ácido sulfúrico, con formación sulfato de calcio hidratado (yeso) que tiene aplicaciones en construcción:
Ca5(PO4)3.OH + 5H2SO4 → 5CaSO4.2H2O + H3PO4
Este método ha sido patentado por la empresa siderúrgica coreana Posco, quienes han instalado una planta piloto en Cachauri, Jujuy, en 2015.
El método no procesa salmueras por evaporación por lo que es significativamente más rápido que los métodos evaporativos, sin embargo, debido a que utiliza ácido fosfórico, que si bien se recupera, puede dejar residuos de fosfatos de magnesio y calcio en forma de lodos contaminantes.
Métodos de adsorción
Se ha estudiado extensamente la adsorción selectiva del litio contenido en salmueras (300-1000 ppm) y agua de mar (0.125 ppm) utilizando adsorbentes como MnO2 , TiO2, hidróxido de aluminio, etc.
La captación de litio en estos sistemas depende de la intercalación de iones litio en redes no estequiométricas de estos óxidos con una capacidad que varía con el tipo de adsorbentes en 3-35 mg/g. Cuando se extrae de soluciones ricas en iones litio como las salmueras (> 5 mg/L) se pueden lograr captaciones de > 20 mg/g.
Conclusiones
El nivel actual de reciclaje de baterías de ion litio es aún limitado, por debajo del 1%, y hay pocas empresas a lo largo de la cadena de suministros en Europa que están involucradas activamente en la recuperación de metales estratégicos presentes en las baterías.
¿Deberían los fabricantes encargarse del coste de reciclar el litio? ¿O tendríamos que ser los consumidores los que pagáramos una ecotasa por ello?
Sea cual sea la respuesta, lo que resulta evidente es que las técnicas reciclaje de estos materiales debe perfeccionarse, al punto de hacerlas rentables y producir el mínimo impacto en el medio ambiente.
Vamos hacia un mundo con cada vez mayor escasez de recursos naturales, si además desperdiciamos aquellos que nos son útiles, llegará el punto en que no dispongamos de los mismos.
Si ahora nos quejamos de que las baterías son caras con Litio abundante, ¿qué pasaría si este metal comenzara a escasear porque lo hemos enterrado en hormigón?