Sections
- Introduction
- Caractéristiques du bore
- Principaux producteurs mondiaux
- Impact du bore sur l’environnement
- Traitement des effluents avec du bore
- Résumé
Introduction
Le bore est un métalloïde qui se combine facilement sous différentes formes en raison de ses trois électrons libres dans la dernière couche, ce qui lui confère un caractère très réactif. Les composés du bore (du mot arabe buraq et de l’ancien persan burah) sont connus depuis des milliers d’années. Dans l’Égypte ancienne, la momification dépendait du natron, un minéral contenant des borates et d’autres sels communs.
En Chine, des cristaux de borax étaient déjà utilisés vers 300 av. J.-C., et dans la Rome antique, des composés de bore étaient utilisés dans la fabrication de verre. À partir du VIIIe siècle, les borates ont été utilisés dans les processus de raffinage de l’or et de l’argent.
En 1808, Humphry Davy, Gay-Lussac et L. J. Thenard ont obtenu du bore d’une pureté d’environ 50 %, bien qu’aucun d’eux n’ait reconnu la substance comme un nouvel élément, ce que fera Jöns Jacob Berzelius en 1824.
Le bore pur a été produit pour la première fois par le chimiste américain W. Weintraub en 1909.
L’importance des produits du bore se reflète dans la grande variété d’applications qu’ils possèdent. Les principales utilisations des borates et des composés de bore sont : dans l’industrie des émaux et des céramiques (sanitaires, vaisselle, céramiques, carrelages), l’industrie du verre, les cristaux et les fibres de verre, les verres Pyrex pour les ustensiles, les lampes et les ampoules, les détergents et les blanchissants, les retardateurs de flamme, les abrasifs, les cosmétiques, dans la préservation du bois, dans les capacitaires, les alliages, la catalyse, le caoutchouc (ignifuge), le ciment (diminue la vitesse de prise), le combustible (borane pour avions et fusées), les tanneries (évite la putréfaction), la pharmacie (antiseptique doux), les peintures (fongicide), les applications nucléaires, en optique, etc. En plus de ces usages industriels, le bore est l’un des 7 micronutriments essentiels pour les plantes, ce qui rend la dosification du bore en tant qu’engrais d’une importance capitale.
Le borophène est l’un des matériaux à la mode. Il y a environ 5-6 ans, le graphène semblait capter l’intérêt mondial en tant que matériau de pointe pour le développement technologique, mais actuellement, le borophène se présente comme un grand candidat pour lui ravir sa place, surtout en matière de nanotechnologie.
Le bore dans la croûte terrestre
La concentration estimée de bore dans la croûte terrestre est de 10 ppm, et sa masse est de 2,4 × 1017 kg.
On sait actuellement que le bore est beaucoup plus abondant dans les roches sédimentaires (300 ppm) que dans les roches ignées (3 ppm), cette différence étant due à quatre caractéristiques : le bore est sublimable, il n’a pas de préférence pour les phases fondues (élément incompatible), sa haute mobilité dans la phase aqueuse et sa forte affinité pour les minéraux argileux (élément lithophile).
Le bore arrive dans la croûte terrestre par différentes voies, à savoir la précipitation atmosphérique, qui contient de petites quantités de bore en solution ; et le volcanisme et l’activité géologique analogue, qui libèrent des roches fondues avec des concentrations variables de bore.
Il existe également des flux de l’océan vers la croûte océanique sous forme de sédimentation et de diagénèse. Les voies de sortie du bore dans la croûte sont l’érosion et les processus de subduction des plaques.
Le bore tend à se concentrer dans les phases résiduelles de la partie fondue, les éléments qui composent la masse de magma se solidifient en fonction de leur point de fusion et de leur compatibilité avec la phase solide, de cette manière, dans les stades successifs de la solidification, la concentration des éléments incompatibles (dont le bore) augmente dans le magma, jusqu’à ce que nous ayons finalement un liquide formé par des éléments incompatibles qui finissent par se solidifier.
Ces dépôts d’éléments incompatibles sont ce que nous connaissons sous le nom de pegmatites. En raison de ce fait, les concentrations de bore sont relativement faibles dans les basaltes (6-0,1 ppm) et plus élevées dans des roches plus cristallisées comme le granite (85 ppm), bien que l’on trouve également de fortes concentrations de bore dans des granites dérivés de roches sédimentaires riches en bore. Les pegmatites peuvent contenir des concentrations de bore allant jusqu’à 1360 ppm.
Lors de la dégradation des roches sous-marines, les roches ignées se dégradent et forment des minéraux argileux qui adsorbent le bore de l’eau de mer, enrichissant ainsi la masse rocheuse en bore.
Les basaltes des îles magmatiques tendent à être enrichis en bore ; cet enrichissement est attribué à la déshydratation des blocs rocheux subductés, riches en bore adsorbé par des minéraux argileux.
Les fractions riches en bore participent au processus de fusion et les roches volcaniques résultantes (andesites et diorites) sont conséquemment enrichies en bore. Les minéraux argileux (tels que les illites, les smectites et les montmorillonites) incorporent le bore de l’eau tant par adsorption que sous forme d’élément de substitution dans la structure.
Les roches sédimentaires des océans tendent à contenir plus de bore que les roches sédimentaires fluviales, car l’eau de mer contient une plus grande concentration de bore que les eaux continentales.
Le bore est adsorbé uniquement à des températures inférieures à 40 °C, à des températures plus élevées (>150 °C), il peut être libéré du minéral, c’est pourquoi, lors du métamorphisme des roches sédimentaires, une grande partie du bore adsorbé est libérée dans l’eau, et si le métamorphisme augmente encore, le bore en tant qu’élément substitut est également libéré, de sorte que les sédiments métamorphiques tendent à contenir des concentrations de bore largement inférieures à celles des roches sédimentaires équivalentes.
Les minéraux principaux dans lesquels nous trouvons du bore sont pour la plupart des roches évaporitiques, comme le borax, hautement soluble dans l’eau ; la colemanite ; la kernite (une forme partiellement déshydratée du borax) et l’ulexite.
Il existe également d’importants minéraux de bore sous forme de gisements de roches ignées, la datolite, le chorlo et l’elbanite, ces minéraux sont classés dans le groupe des borates (sels inorganiques composés de bore et d’autres ions), à l’exception des deux derniers minéraux mentionnés, qui appartiennent au groupe des tourmalines, qui apparaissent particulièrement dans des filons de type pegmatitique.
Le bore dans l’hydrosphère
Le bore se trouve dans l’eau de mer à des concentrations estimées à 4,6 ppm et dans une masse de 5,4 × 1015 kg.
Il se présente sous forme de deux molécules hydratées ; le B(OH)3 trigonal et le B(OH)4- tétraédrique.
La proportion des deux formes dépend du pH de l’eau de mer et l’équilibre entre les concentrations des deux formes se trouve à un pH de 8,7-8,8, dans des milieux plus basiques, la forme tétraédrique prédomine et dans des milieux plus acides, la forme trigonal.
En raison du long temps de résidence du bore dans l’eau de mer (25 millions d’années), les concentrations de B(OH)3 et B(OH)4- ne varient pas significativement dans les différents océans.
Le bore arrive dans l’hydrosphère depuis les continents par le cycle de l’eau et par des processus d’érosion des roches, et depuis la croûte océanique par circulation hydrothermale, il provient également de la précipitation atmosphérique.
Le bore dans l’atmosphère
L’atmosphère contient environ 2,7 × 108 kg de bore. Celui-ci se trouve dans la troposphère sous forme gazeuse à 97 % ; les 3 % restants se trouvent sous forme solide sous forme de particules.
Les temps de résidence considérés pour le bore troposphérique sous sa forme gazeuse sont de 19 à 36 jours, pour le bore particulaire, ils sont de 2 à 6 jours. En raison de ces temps de résidence si bas, les concentrations de bore sont variables à différents points de l’atmosphère.
Le bore arrive dans l’atmosphère par l’évaporation de l’eau de mer, puis peut revenir aux océans ou aux continents par précipitation.
Le bore dans les plantes
Pour les plantes, le bore est un nutriment essentiel. Il semble jouer un rôle fondamental dans le maintien de la structure de la paroi cellulaire (par la formation de groupes cis-diol) et des membranes.
C’est un élément peu mobile dans le phloème, c’est pourquoi les symptômes de carence apparaissent généralement dans les jeunes feuilles et ceux de toxicité dans les feuilles matures.
Un excès de bore est nuisible pour certaines plantes peu tolérantes à cet élément, pouvant agir sur leurs nervures en les affaiblissant. Dans les pommiers et les poiriers, la carence en bore se manifeste dans les fruits sous forme de malformation interne.
Caractéristiques du bore
Les principales caractéristiques physiques et chimiques du bore sont les suivantes :
| Nom, symbole, numéro | Bore, B, 5 |
| Série chimique | Métalloïdes |
| Groupe, période, bloc | 13, 2, p |
| Masse atomique | 10,811(7) u |
| Configuration électronique | [He]2s22p1 |
| Dureté Mohs | 9,5 |
| Électrons par niveau | 2, 3 |
| Rayon moyen | 85 pm |
| Électronégativité | 2,04 (échelle de Pauling) |
| Rayon atomique (calc) | 87 pm (rayon de Bohr) |
| Rayon covalent | 82 pm |
| État(s) d’oxydation | 3 (légèrement acide) |
| État ordinaire | Solide (non magnétique) |
| Densité | 2460 kg/m3 |
| Point de fusion | 2349 K (2076 ℃) |
| Point d’ébullition | 4200 K (3927 ℃) |
Le bore présente une multitude de formes allotropiques qui ont comme élément structurel commun un icosaèdre régulier. L’agencement des icosaèdres peut se faire de deux manières différentes :
- Union de deux icosaèdres par deux sommets, par des liaisons covalentes normales B – B
- Union de trois icosaèdres par trois sommets, par une liaison à trois centres avec deux électrons.
Dans ces unions possibles, dans le bore cristallin, les icosaèdres peuvent s’associer de plusieurs manières pour donner les allotropes correspondants :
- Bore tétraédrique (T – 50) : formé par 50 atomes de bore par cellule unitaire, qui sont quatre unités icosaédriques reliées entre elles par quelques liaisons B – B et de deux borons élémentaires qui agissent comme liaison tétraédrique entre les icosaèdres. Il possède une densité de 2,31 g/cm3.
- Bore rhomboédrique alpha (R – 12) : formé par des couches d’icosaèdres reliées parallèlement. Les liaisons intralaminaire se font par des liaisons à trois centres, tandis que les liaisons interlaminaires se produisent par des liaisons à deux centres. La densité de ce type de bore est de 2,46 g/cm3, et il présente une couleur rouge clair.
- Bore rhomboédrique beta (R – 105) : formé par douze icosaèdres B12 ordonnés en forme icosaédrique autour d’une unité centrale de B12, c’est-à-dire B12(B12)12. Il présente une densité de 2,35 g/cm3.
Isotopes du bore
Dans la nature, on trouve deux isotopes de bore, 11B (80,1 %) et 10B (19,9 %).
Les résultats de leurs masses se différencient par une large gamme de valeurs qui se définissent comme la différence entre les fractions 11B et 10B et traditionnellement exprimée en parties par mille, dans des eaux naturelles allant de -16 à 59.
Il existe 13 isotopes connus de bore, l’isotope de plus courte durée étant 7B qui se désintègre par émission de protons et désintégration alpha.
Il a une demi-vie de 3,5×10−22s. Le fractionnement isotopique du bore est contrôlé par les réactions de changement des composés spéciaux B(OH)3 et B(OH)4.
Les isotopes de bore se fractionnent également lors de la cristallisation des minéraux, lors des changements de phase de H2O dans des systèmes hydrothermaux, et lors de l’altération hydrothermale des roches.
Principaux producteurs mondiaux
Le bore donne naissance à divers composés, des oxydes simples à des structures très complexes de type polymérique.
Parmi eux se trouvent les oxydes appelés borates. Les gisements de borates d’importance commerciale se localisent uniquement dans un nombre réduit de régions géographiques dans le monde : Anatolie (Turquie), Californie et Nevada (sud-ouest des États-Unis), la Puna Sud-américaine (sud du Pérou, sud-ouest de la Bolivie, nord du Chili et nord-ouest de l’Argentine), Inder (Russie) et Asie centrale (Chine et Russie).
La Puna Sud-américaine possède les troisièmes réserves mondiales de borates, après la Turquie et la côte ouest des États-Unis.
Les gisements de la Puna Sud-américaine produisent principalement de l’ulexite, du tincal, de la colemanite et de l’hydroboracite. Ceux-ci constituent le minéral utile, de valeur commerciale, qui se trouve mélangé à d’autres matériaux sans valeur qui constituent la gangue, dont il doit être séparé.
L’ulexite est un borate de sodium et de calcium, peu soluble dans l’eau froide, accompagné de gangue constituée de sables, d’argiles, de gypse, de calcite, le tout imprégné dans une saumure composée principalement de chlorures et de sulfates de sodium. Les borates connus sous le nom de « durs » (tincal, colemanite et hydroboracite) possèdent une gangue constituée de roches (calcite, dragonite, argile, tobas, tufas) et d’impuretés de fer.
Le tincal est un borate de sodium, soluble dans l’eau, propriété qui est utilisée pour le séparer de la gangue insoluble, et obtenir par la suite du borax par cristallisation par refroidissement. La colemanite est un borate de calcium avec cinq molécules d’eau dans sa structure et l’hydroboracite est un borate de calcium et de magnésium avec six molécules d’eau. Toutes deux ont comme impuretés principales le fer et l’arsenic.
Impact du bore sur l’environnement
Ni le bore ni les borates ne sont toxiques pour les êtres humains et les animaux. La DL50 pour les animaux est d’environ 6 g par kg de poids corporel. Les substances avec une LD50 supérieure à 2 g sont considérées comme non toxiques.
La dose minimale létale pour les êtres humains n’a pas été établie, mais une consommation de 4 g/jour a été rapportée sans incidents, et les doses cliniques de 20 g d’acide borique pour la thérapie par capture de neutrons n’ont pas causé de problèmes.
Certains poissons ont survécu pendant 30 minutes dans une solution saturée d’acide borique et peuvent survivre plus longtemps dans des solutions de borax. Les borates sont plus toxiques pour les insectes que pour les mammifères.
Le borane et certains composés gazeux similaires sont très toxiques. Ce n’est pas un élément intrinsèquement vénéneux, mais sa toxicité dépend de la structure.
Les boranes (composés de bore d’hydrogène) sont toxiques, ainsi que facilement inflammables et nécessitent des soins particuliers lors de leur manipulation. Le borohydrure de sodium présente un danger d’incendie en raison de son caractère réducteur, et de la libération d’hydrogène au contact de l’acide. Les halogénures de bore sont corrosifs.
Le bore dans la santé humaine
Scientifiquement, il n’a pas été prouvé que le bore soit une substance considérée comme essentielle dans le régime alimentaire humain ou qu’il soit un besoin diététique chez les vertébrés et les invertébrés, ou du moins de la même importance qu’il occupe chez les végétaux.
Le corps humain contient au moins 0,7 mg par kilo de poids de bore obtenu par la consommation d’eau et de végétaux. Un humain consomme dans son apport quotidien environ 0,8 à 2,5 mg de bore par kilo de poids sans que cela ne manifeste de symptômes.
Des régimes forcés de 5 g par jour peuvent provoquer des nausées, des diarrhées et des vomissements ; certains auteurs suggèrent que 20 g par jour de bore peuvent être mortels chez des organismes sensibles, mais cela n’a pas été vérifié.
D’autres bibliographies semblent associer l’apparition d’arthrite à l’ingestion de cet élément et d’autres publications estiment que cet élément doit être considéré comme essentiel pour le métabolisme du calcium, du cuivre, du magnésium et la fixation de l’azote.
Le bore peut être toxique pour les végétaux, même à des niveaux de concentration faibles. Une concentration de bore inférieure à 1 mg/l est essentielle pour le développement des plantes. La plupart des plantes montrent des problèmes de toxicité lorsque la concentration de bore dépasse 2 mg/l.
L’Organisation mondiale de la santé recommande une concentration de bore dans l’eau potable inférieure à 0,5 mg/l. Les normes de l’UE exigent un niveau de bore inférieur à 1 mg/l.
Traitement des effluents avec du bore
Le bore, en raison de sa nature, n’est pas facile à éliminer des matrices aqueuses. Les techniques classiques de coagulation, de sédimentation et même d’osmose inverse ne sont pas satisfaisantes.
Certaines expériences ont montré que l’application de systèmes de résines d’échange ionique en combinaison avec des zéolithes et du charbon actif est beaucoup plus prometteuse comme moyen de réduire cet élément.
Tableau des traitements habituels des effluents avec du bore
| Méthode | Concentration initiale de bore | Efficacité | Processus | Application industrielle | Coûts relatifs |
| Précipitation alcaline | Élevée | Basse | Discontinu | Basse | Très bas |
| Adsorption Me(OH)x | Élevée | Très élevée | Discontinu | Élevée | Bas |
| Adsorption sur argile | Élevée | Très élevée | Discontinu | Moyenne | Bas |
| Échange ionique | Basse | Très élevée | Continu (régénération) | Élevée | Élevés |
| Extraction | Basse | Élevée | Continu | Basse | Élevés |
| Osmose inverse | Basse | Élevée | Continu (nettoyage) | Élevée | Élevés |
| Électrodialyse | Basse | Élevée | Continu | Basse | Élevés |
| Évaporation | Élevée | Élevée | Continu | Moyenne | Élevés |
Les solutions les plus utilisées sont : Osmose inverse, Échange ionique et le traitement des effluents par Évaporation.
La désalinisation par osmose inverse
La quantité de bore dans l’eau de mer varie de 4 à 5,5 mg/L, proportionnelle à la salinité. Elle provient principalement du rejet des stations de traitement des eaux usées, où l’on commence à utiliser des savons et des détergents, ainsi que des engrais agricoles.
Le bore est présent dans l’eau sous forme d’acide borique H3BO3 et de borate H3BO2-. L’espèce de bore prédominante dépend du pH de l’eau.
La valeur pKa de H3BO3/H3BO2- est de 9,2, par conséquent, l’équilibre est normalement déplacé vers la gauche, car la valeur de pH standard de l’eau de mer est de 8.
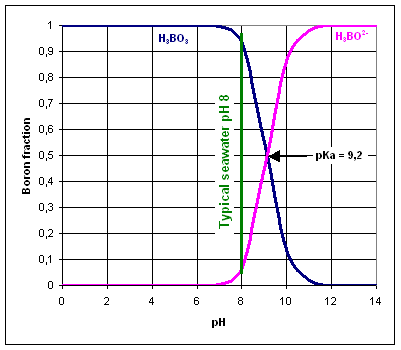
Les membranes d’osmose inverse sont très efficaces pour éliminer des espèces chargées comme l’ion borate, plutôt que des molécules neutres comme l’acide borique.
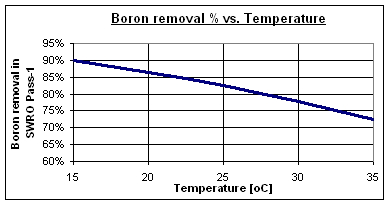
Les taux typiques d’élimination du bore à pH 8 se situent entre 73 et 90 % pour des membranes standard d’osmose inverse d’eau de mer à fort rejet, selon la température de l’eau. Certaines membranes spéciales à haute élimination de bore peuvent atteindre des valeurs allant jusqu’à 95 %.
Normalement, l’eau de mer à haute salinité a une forte teneur en bore et se trouve dans des zones à climat très chaud, comme le Golfe Persique, la Mer Rouge, la Méditerranée orientale et la Mer des Caraïbes.
À 30 °C, l’élimination du bore est réduite à 78 %, laissant 1,15 mg/l dans le courant de perméat du Pas-1. Par conséquent, un processus spécifique d’élimination du bore est nécessaire pour atteindre les 0,5 mg/l exigés par l’OMS.
Élimination du bore de l’eau désalinisée
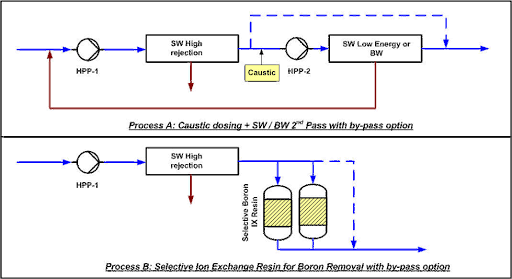
Il existe deux processus principaux pour produire de l’eau potable avec moins de 0,5 mg/L de bore, selon la salinité de l’eau, la concentration de bore et la température.
Processus A : SWRO en 2 étapes :
Dans le pas-2 d’osmose inverse, de la soude caustique est ajoutée pour augmenter le pH à 9,5. Une partie du perméat du pas-1 peut être bypassée pour maintenir une certaine quantité de minéraux dans l’eau. Le deuxième pas peut être composé de membranes d’eau de mer à faible énergie si la température et la salinité sont élevées ou de membranes à fort rejet d’eau saumâtre en cas de conditions moins sévères.
Processus B : SWRO + IX :
Une résine d’échange ionique est ajoutée avec ou sans bypass, selon la concentration de bore et les conditions de traitement.
La résine, qui doit être sélective pour le chlore, est régénérée in-situ avec de la soude caustique et de l’acide chlorhydrique. Pour que la production soit continue, un système à double colonne est nécessaire.
Le système de traitement pour l’élimination du bore par échange ionique permet d’éliminer de toute eau l’excès de cet élément, qui, dans certaines cultures (principalement les fruits à noyau ou à pépins), peut atteindre une concentration toxique ou nuisible pour la plantation.
Cette toxicité peut avoir une incidence plus importante lorsque des eaux usées sont utilisées pour l’irrigation, ou des eaux souterraines contaminées par ces dernières.
L’influent traverse la résine d’échange ionique, spécialement conçue pour l’élimination du bore dans des solutions aqueuses, ce qui permet d’obtenir à la sortie une eau avec une réduction du bore de 90 %.
La capacité d’échange est limitée et lorsque la résine a atteint son épuisement, sa régénération est effectuée.
La régénération des résines est totalement automatisée et se fait par le passage d’une certaine concentration d’acide à travers le lit de résines, éliminant ainsi le bore retenu, permettant le stockage de la solution aqueuse de régénération, de manière à pouvoir être gérée comme un déchet par la suite.
Les effluents riches en bore provenant des résines ou des membranes d’osmose inverse peuvent être concentrés jusqu’à des valeurs permettant leur récupération, par des techniques d’évaporation à vide. Condorchem – Envitech a la capacité d’offrir des solutions intégrales pour cette application.
Résumé
Le bore est un élément chimique très réactif qui apparaît dans la nature combiné sous diverses formes. Il a de multiples applications industrielles et un avenir important basé sur l’apparition du borophène, comme successeur du graphène, dont les propriétés en font un candidat sérieux pour des applications en nanotechnologie.
Bien qu’il soit nécessaire à la vie des plantes et bien toléré par les êtres humains et les animaux, il existe des limites à ne pas dépasser pour qu’il ne devienne pas nocif.
Une des solutions techniques utilisées depuis de nombreuses années pour lutter contre la sécheresse est la désalinisation par osmose inverse, mais le concentré est riche en cet élément et de plus, l’eau désalinisée reste souvent au-dessus de 0,5 ppm, limite maximale établie par l’OMS, ce qui nécessite des traitements complémentaires qui séparent davantage de bore.
Ainsi, les options consistent à faire passer le perméat par un second passage d’osmose inverse, ou bien par un lit de résines spécifiques. Dans le cas des résines, la quasi-totalité du bore présent est éliminée.
Dans les deux cas, il reste un concentré qui pourra être récupéré après concentration dans un système d’évaporation à vide, dans lequel Condorchem – Envitec a une expérience éprouvée.
Références bibliographiques et sur Internet
http://oa.upm.es/155/1/05200006.pdf
https://rua.ua.es/dspace/bitstream/10045/13838/1/Tesis_Chillon.pdf