Sections
Introduction
Les éléments chimiques appelés Terres Rares, ou Lanthanides, se trouvent dans la période correspondant au Lanthane. Ils sont communément exprimés sous forme d’oxydes de terres rares sous la dénomination ETR ou REE, Rare Earth Elements. Ce groupe d’éléments est composé de 15 éléments ayant des propriétés chimiques très similaires mais qui diffèrent dans leurs propriétés physiques, ce qui complique leur séparation.
Cette séquence d’éléments présente, en raison de sa configuration électronique, la contraction lanthanide. Ce fait représente la diminution progressive de la taille de l’atome à mesure que le numéro atomique augmente. Le numéro atomique de ces éléments varie de 57 (La) à 71 (Lu) et ce groupe inclut le Sc (21) et le Y (39) (Puche, Cascales, Porcher et Maestro) (Gambogi et Curier, 2010).
La configuration électronique de ces éléments indique que leur état d’oxydation le plus stable est le trivalent, bien qu’ils puissent stabiliser les états +2 (Eu, Yb, Sm) et +4 (Ce, Pr, Tb). En raison de leur distribution électronique, ils présentent des propriétés magnétiques et optiques particulières qui se manifestent, par exemple, dans le cas du Néodyme (aimants de grande puissance).
Les terres rares correspondent à 17 éléments chimiques, parmi lesquels se trouvent les 15 lanthanides (lanthane, cérium, praséodyme, néodyme, prométhium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium et lutécium), ainsi que le scandium et l’yttrium, qui sont ajoutés en raison de leurs similitudes physico-chimiques avec les lanthanides (principalement leur configuration électronique, potentiels d’ionisation, caractère hautement électropositif et similitude dans leur rayon ionique (+3)), ce qui fait que les éléments de terres rares sont hautement interchangeables entre eux dans une grande quantité de minéraux (par le biais d’une réaction de déplacement de métal).
Les terres rares sont classées en trois groupes : terres rares légères (LREEs : light rare earth elements), terres rares lourdes (HREEs : heavy rare earth elements) et le groupe des terres rares intermédiaires (MREEs : middle rare earth) qui s’étend de l’élément samarium au gadolinium.
Minéraux d’origine
Il existe dans la nature environ 200 minéraux contenant des terres rares dans leur composition. Normalement, des associations de différents éléments se produisent dans un même minéral en raison de leurs propriétés chimiques similaires. Le Cérium est l’élément des terres rares qui se trouve en plus grande proportion dans la croûte terrestre (plus que le cuivre) et le Néodyme et le Lanthane sont plus abondants que le Nickel, le Plomb et le Cobalt.
Actuellement, la Monazite [(Ce, La, Th) PO43], le Xénotime [(YPO4)3] et la Loparite (Na,Ce,Sr)(Ce,Th)(Ti,Nb)2O6 sont utilisés comme minerais de terres rares, la Monazite étant le plus riche (Puche, Cascales, Porcher et Maestro).
La Monazite est un minéral du groupe des phosphates, de formule [(,,,ℎ)4] qui correspond au deuxième minerai le plus important de LREEs avec des réserves en Australie, au Brésil, en Chine, en Inde, au Sri Lanka et aux États-Unis. Les gisements contenant de la monazite contiennent souvent du thorium, un élément radioactif, c’est pourquoi de nombreux pays l’écartent comme source de terres rares en raison des dommages qu’il pourrait causer à l’environnement.
Les concentrations d’éléments de terres rares et de thorium dans le minerai de monazite varient selon le gisement, avec une moyenne de 70 % de terres rares (principalement cérium, néodyme et lanthane) et 12 % de thorium (des pourcentages d’uranium peuvent également être trouvés, qui, tout comme le thorium, est un élément radioactif).
La monazite est un orthophosphate de terre rare et de thorium (RTh)PO4. C’est le minéral contenant le plus de terres rares, constituant un sous-produit de l’ilménite qui accompagne le zircon.
La Bastnaésite est un fluorocarbonate (RFCO3) qui contient des terres rares, en particulier Ce, Nd, Eu et La. Les réserves les plus importantes se trouvent en Mongolie et en Californie.
Ce minéral fluorocarbonaté de formule [(,)3(,)] se trouve dans des dépôts, existant en Chine et aux États-Unis, correspondant aux plus grandes réserves de terres rares légères (principalement lanthane, cérium et néodyme) au monde. Ils contiennent une très faible concentration de thorium et leur contenu en éléments de terres rares est d’environ 70 %.
Le Xénotime est un orthophosphate de terres rares et yttriques, avec une teneur élevée en cérium et thorium. Le gisement le plus important de ce minéral se trouve à Guandong (Chine), bien que sa teneur en uranium et thorium et l’activité radioactive qui leur est associée limitent son exploitation. D’autres gisements moins pertinents se trouvent en Californie (États-Unis), en Malaisie et en Indonésie.
L’Euxénite est un minéral de formule [(,,,,ℎ)(,,)26]. Il se trouve normalement sous forme de tantaloniobate (minéraux où Ta et Nb forment le composé) de titane, terres rares, thorium et uranium. Il existe des dépôts dans l’Idaho (États-Unis), en Norvège et à Madagascar.
La loparite est un niobiotitanate de terre rare situé dans la péninsule de Kola, en Russie, avec des concentrés d’environ 32 % en oxydes de terres rares, principalement cériques.
Le Xénotime est le principal minéral de HREEs dans le monde, spécifiquement de l’yttrium. Il contient en moyenne 67 % d’éléments de terres rares et les principaux gisements ont une teneur en xénotime de 0,5-5 %. Il existe des gisements de ce minéral en Californie (États-Unis), en Malaisie et en Indonésie.
L’Allanite est un minéral de formule chimique [(,,)(22+)(//4) ∙ 27]. C’est un minéral du groupe épidote (minéral de type silicate de formule générale 23(4)3(,), où A et B peuvent être remplacés par différents éléments), présent sous 3 formes contenant cérium, lanthane et yttrium.
Il se trouve dans des environnements ignés, métamorphiques et hydrothermaux. Le pourcentage d’éléments radioactifs (thorium et uranium) peut varier entre des traces de l’élément jusqu’à 3 %, tandis que sa concentration en éléments de terres rares est en moyenne de 5 %.
En raison de la présence d’éléments radioactifs et de sa faible concentration en éléments de terres rares, il n’est pas extrait comme minéral principal dans les exploitations minières.
Enfin, il convient de souligner comme réservoir important un certain type d’argiles riches en terres rares. Ces argiles spécifiques proviennent de l’exposition à l’intempérie de roches ignées communes contenant des terres rares, ce qui peut provoquer la lixiviation de ces roches et une absorption ultérieure à la surface de minéraux aluminosilicates de caractère argileux (kaolinite, illite et smectite), les enrichissant en terres rares et les rendant viables pour une extraction économique.
Bien que les concentrations d’éléments de terres rares soient généralement faibles (0,3 % en moyenne) par rapport aux minéraux décrits précédemment, le traitement de ce type de gisement est de moindre complexité, ce qui le rend économiquement compétitif.
Ce type de dépôts existe dans le sud de la Chine et au Kazakhstan. Bien que les réserves argileuses ne constituent que 2,9 % des réserves en Chine, elles représentent 35 % de ses exportations de terres rares.
Concrètement, en Chine (Xungu, Longnam), on trouve des réserves de plus de 10MTm exprimées comme RO (oxydes de terres rares). Ces gisements situés en Chine sont des gisements de surface et leur extraction est relativement facile et hautement rentable.
Les ions de terres rares sont adsorbés par échange ionique dans les réseaux cristallographiques des argiles. Les éléments de terres rares sont récupérés à partir des lixiviations des argiles avec des solutions salines. 50 % des réserves mondiales de terres rares se trouvent en Chine.
Les procédures industriellement en cours pour leur récupération visent à obtenir des concentrés d’ETR à partir des minéraux indiqués. À l’exception de la bastnasite, de nombreux concentrés d’ETR sont obtenus comme sous-produit ou résultat de processus sidérurgiques ou pyrométallurgiques (Orrego, 1998 ; Orrego, 2000 ; Vega, 2000 ; Hedrick, 1999 ; Dwivedi, 1982 ; Harrah, 1967 ; Sunur et al., 1985 ; Alarcon, 1998 ; Lapido, 1994 ; Sundaram, 1987 ; Swanina et Nair, 1989 ; The Humphreys Investment Co, 1970).
Propriétés technologiques
Au niveau mondial, les TR sont des éléments qui, grâce à leurs propriétés physiques et chimiques, ont permis leur utilisation dans une série de produits de haute technologie. En premier lieu, l’industrie des aimants permanents, de plus en plus déterminante dans les technologies médicales (techniques d’imagerie par résonance magnétique nucléaire, TEP), technologies électroniques, technologies de mobilité (ferroviaires), technologies hybrides, etc.
Initialement, les aimants permanents étaient fabriqués à partir d’aciers, d’alliages métalliques à base ferrique avec de faibles valeurs d’aimantation résiduelle et de champs coercitifs. Les terres rares offrent de fortes valeurs de champs coercitifs et de moments magnétiques qui dépassent les valeurs des aimants ferreux.
Les terres rares ont leur point faible dans le paramagnétisme à température ambiante. Mais ce point a été surmonté par les alliages Sm2Co17 et surtout les plus récents de Nd2Fe34B, avec des valeurs d’énergie magnétique de 450KJ/m3. De même, des alliages GdTbFeCo de grande efficacité ont été découverts pour l’utilisation dans les systèmes de mémoire.
L’utilisation technologique des terres rares dans la construction de matériaux optiques est un autre domaine d’influence actuel. En particulier, il s’agit de la construction de lampes tricolores dans lesquelles la lumière émise est une combinaison de trois longueurs d’onde 450nm ; Ba Mg2O16Al27Eu2+/556nm ; (Ce/Tb)Mg Al11O19/610nm ; Y2O3Eu3+. Ces systèmes luminescents reproduisent la lumière du soleil et obtiennent une efficacité lumineuse très élevée.
Dans cette même ligne, l’utilisation des terres rares dans la technologie des écrans intensificateurs de RX. Classiquement, le tungstate de calcium (CaWO4) a été utilisé.
Ces matériaux luminescents ont pour but de réduire le temps d’exposition à la radiation du patient et d’obtenir une résolution correcte. Ces matériaux sont en train d’être remplacés dans le but d’améliorer cette efficacité. Gd2O2ScTb+, LaOBrTm+ et YTaO.
De même, les écrans de télévision, les moniteurs d’ordinateurs et les écrans de téléphones mobiles reproduisent la coloration à partir de groupes chromatophores dopés avec des lanthanides. La couleur rouge, par exemple, est reproduite par l’oxysulfure d’yttrium dopé avec de l’europium (Y2O3:Eu3+). Un autre domaine d’application des terres rares est celui des lasers, en particulier les lasers au néodyme de grande efficacité monochromatique, cohérence et directionnalité. (Sáez, Cascales, Porcher, Maestro ; 2000).
Processus Extractif
Monazite
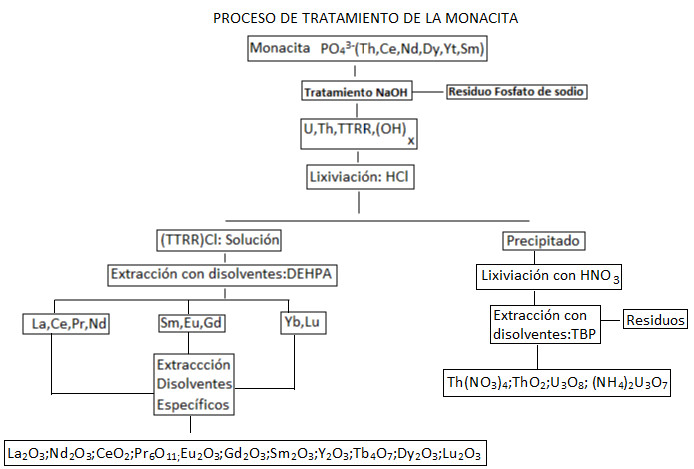
On prendra comme référence l’un des minéraux porteurs de terres rares les plus importants : la monazite.
On part du concentré de monazite qui est attaqué avec de l’acide sulfurique à une température de 200ºC, dans le but de lixivier les éléments lanthanides qui font partie du concentré.
De même, dans le processus, des impuretés telles que l’uranium, le thorium, certains phosphates et sulfates se dissolvent, permettant le concentré secondaire de ce matériau radioactif. La solution sera neutralisée lentement.
Dans un premier temps, on procède à un traitement avec de l’hydroxyde d’ammonium. À des valeurs de pH 1, le sulfate de thorium précipite sous sa forme insoluble. Avec le sulfate de thorium, une petite partie des terres rares précipite. À un pH de 2,3, la majeure partie des terres rares précipite.
Enfin, à un pH de 6, le thorium précipite sous forme d’hydroxyuranate. Les précipités correspondant aux valeurs de pH 1 et pH 6 sont traités avec du phosphate de tributylique afin de séparer l’uranium des terres rares et d’améliorer le rendement du processus. À ce stade, on obtient un concentré de terres rares.
En ajoutant du sulfate de sodium, on produit le précipité des terres rares légères (REE), obtenant ;
2(4)3 ∙ 24 ∙ 2
L’yttrium, les terres rares lourdes et les éléments radioactifs restent en solution. Le précipité, une fois séparé, est traité avec de l’hydroxyde de sodium formant un concentré de terres rares. Celui-ci est séché à 120ºC.
Le précipité est redissous dans de l’acide nitrique et le thorium et le cérium précipitent sélectivement en ajoutant l’hydroxyde d’ammonium à un pH de 2,8.
Par la suite, en retirant ce premier précipité, on continue à ajouter de l’hydroxyde d’ammonium, précipitant le reste des terres rares sous forme d’hydroxyde. Les éléments de terres rares lourdes en solution peuvent être séparés d’autres éléments radioactifs et concentrés, en utilisant un extractant tel que le phosphate de tributylique.
Pour récupérer le thorium et les terres rares de la dissolution, on procède à traiter la solution acide avec de l’oxalate de sodium, précipitant le thorium et les terres rares à pH 1,5, l’uranium restant en solution. Le précipité d’oxalate est traité avec de l’hydroxyde de sodium, précipitant les terres rares.
Ce précipité est calciné et traité avec de l’acide nitrique dans le but de redissoudre et purifier l’extraction des terres rares. Cette dissolution acide est traitée avec du phosphate de tributylique, obtenant un extrait organique avec du thorium et du cérium et une solution avec des terres rares.
L’extrait est soumis à une étape de purification avec du nitrite de sodium, obtenant du nitrate de cérium dans la phase aqueuse et du nitrate de thorium dans la phase organique.
Argiles
Le plus grand volume de terres rares extrait provient des gisements argileux de Chine. La richesse en terres rares n’est pas élevée mais la facilité d’extraction favorise son exploitation. Cette facilité est basée sur la forme ionique avec laquelle les ions lanthanides interagissent avec la structure silicatée de l’argile.
Les terres rares se trouvent sous forme cationique (+3), facilement extractible. Le processus d’extraction repose sur l’utilisation de solutions concentrées de cations monovalents (Na2SO44)2SO44Cl).
Dans l’interaction, un échange ionique se produit entre les ions monovalents et les ions lanthanides. Les terres rares passent en solution sous forme de sulfates et/ou de chlorures.
Cette solution est traitée avec de l’oxalate de sodium de manière à former les oxalates insolubles des lanthanides, précipitant dans la solution. Ce précipité d’oxalate est calciné à 900ºC pour obtenir les oxydes. Ce concentré d’oxydes récupère entre 80-90 % des terres rares présentes dans l’argile originale.
À Madagascar, on utilise l’eau de mer pour lixivier les argiles et ensuite précipiter les terres rares avec des oxalates.
Processus de séparation et de purification
L’utilisation technologique de ces matériaux exige un haut degré de pureté dans leur obtention. Cela a conduit à développer de nouveaux systèmes extractifs plus efficaces que les traditionnels.
Les terres rares peuvent être lixiviées par des nitrates, chlorures et sulfates. Une fois qu’un concentré de terres rares est atteint, un processus de séparation et de purification doit être initié.
Oxydation sélective
Dans un premier temps, on peut réaliser une oxydation sélective en oxydant le cérium, le praséodyme et le terbium d’un état (+3) à un état (+4). Dans le cas du praséodyme, si l’oxydation se produit sous une pression élevée d’oxygène, elle peut se rapprocher de la composition PrO2.
Le praséodyme et le terbium ne sont pas stables en solution aqueuse lorsqu’ils sont oxydés à leur état tétravalent, il est donc relativement facile de les précipiter à partir d’une solution d’hydroxyde d’éléments de terres rares (se forme en dissolvant le mélange d’oxydes avec une solution d’hydroxyde de potassium), en utilisant du chlorate de potassium (KClO3) comme agent oxydant.
Le cérium est l’élément de terres rares le plus abondant et, par conséquent, celui de moindre valeur commerciale. Il peut être oxydé à son état tétravalent en chauffant le mélange d’oxydes à 650 ºC dans l’air, ou en séchant des hydroxyde d’éléments de terres rares dans l’air à 120-130 ºC.
Dans les solutions aqueuses où les éléments sont dissous sous forme d’hydroxyde, le cérium peut être oxydé par chloruration ou électrolyse. Le cérium peut également être oxydé en solution en injectant de l’ozone comme agent oxydant. Pour récupérer le cérium oxydé (état tétravalent), on peut dissoudre sélectivement le mélange d’éléments de terres rares dans un acide dilué où l’oxyde de cérium (IV) a une faible solubilité.
L’oxyde noir se dissout dans l’acide avec libération d’oxygène pour donner des solutions vertes ou des sels verts ayant une application dans l’industrie de la céramique.
Les éléments tels que le samarium, l’europium et l’ytterbium sont moins abondants que le césium, c’est pourquoi ils doivent être concentrés avant d’être traités chimiquement pour leur obtention. L’europium (III) peut être réduit à europium (II) par cathode de mercure. L’obtention du samarium peut être réalisée à partir d’amalgames de lithium.
Méthode d’extraction supercritique
On peut obtenir les carbonates de lanthane, néodyme, samarium, europium, gadolinium, dysprosium et holmium à partir d’un extrait de terres rares par le traitement d’une suspension aqueuse des oxydes avec du CO2 à une température égale ou supérieure à 31ºC et à une pression de 71,2 atm.
Dans ces conditions, les carbonates Pr (III), Er(III), Yb(III) et Tb(III) ne se forment pas ou le font avec un rendement très faible. Cette technique de séparation a également été utilisée dans la séparation des lanthanides de l’état d’oxydation (III) de ceux correspondant à l’état (IV).
Les conditions d’opération sont de 40ºC et 100 atm, formant après une heure de réaction les carbonates de lanthane, néodyme, samarium, europium, holmium, prométhium et thulium à l’état d’oxydation (III). De cette manière, on obtient un précipité carbonaté, susceptible d’être séparé et traité avec de l’acide chlorhydrique. Cette dissolution peut être traitée avec des solvants ou des résines d’échange ionique.
Extraction avec solvants
On part d’un concentré de terres rares provenant de l’étape de lixiviation et on procède à alimenter l’étape d’extraction avec des solvants. À cette étape, on sépare les terres rares lourdes (terbium, dysprosium, holmium, erbium, thulium, ytterbium, lutécium et yttrium), intermédiaires (samarium, europium et gadolinium) et légères (lanthane, cérium, praséodyme et néodyme).
Par la suite, par extraction avec des solvants spécifiques, chaque oxydes de terres rares spécifiques sera séparé. Enfin, les purifications seront effectuées avec des techniques d’échange ionique ou des techniques chromatographiques. Les principaux agents extractifs dans le domaine des terres rares sont ;
- Acides carboxyliques. Ce sont des acides abordables à prix modéré, malgré l’inconvénient de leur solubilité dans l’eau. Parmi les acides carboxyliques les plus utilisés, on trouve l’acide versatique 10, les acides naphténiques et l’acide 2-bromodécanoïque, tous dilués dans du xylène. L’acide naphténique varie sa solubilité en fonction du pH. À un pH de 4, la solubilité est de 0,09 g/l et varie jusqu’à 0,9 g/l à un pH de 6,5. La solubilité de l’acide versatique varie entre 0,7 g/l et 0,25 g/l. L’acide 2-bromodécanoïque fonctionne à des valeurs plus acides. L’effet stérique de la molécule de l’acide influence l’extraction des lanthanides et est lié au numéro atomique de l’élément métallique.
- Acides alkylphosphoriques. L’acide le plus utilisé est le DEHPA (acide di-2-éthylhexylphosphorique). Cet acide est utilisé dilué dans du kérosène. Par exemple, HCl 0,1M par une solution de DEHPA 0,2M dans du kérosène. On observe que l’extraction de ces éléments s’améliore dans l’ordre La < Ce < Nd < Sm < Eu < Gd < Tb < Dy = Y < Ho < Er < Tm < Yb < Lu, diminuant la valeur du coefficient de distribution avec l'augmentation de la température. Un autre type d'acide alkylphosphorique utilisé est l'EHEHPA (acide 2-éthylhexyl-2-éthylhexylphosphorique), également dilué dans du kérosène. Une formulation utilisée est celle de HCl 0,1M et la concentration de l'agent d'extraction dans le kérosène 0,2M. Dans ce système, l'extraction du métal augmente avec le numéro atomique bien qu'elle soit inférieure par rapport au système du DEHPA. L'utilisation des acides phosphoniques et/ou des acides phosphiniques améliore la séparation entre les lanthanides contigus.
- Hydroxyoximes. En particulier, des agents acides ayant la capacité de former des chélates. Ces extractants ont été couramment utilisés dans le traitement du Cu, mais leur utilité dans le traitement des terres rares s’étend de plus en plus. Par exemple, le SME 529 (actuellement LIX 84) a été utilisé pour étudier l’équilibre d’extraction du Ce(III) et La(III) dans un milieu chlorure sodique, l’agent d’extraction étant dilué dans du n-heptane. Le LIX 70 a également été utilisé pour l’extraction de ces deux terres rares (25). Dans ce cas, comme diluants de la phase organique, le kérosène et le n-heptane ont été essayés, le milieu aqueux étant NaCl. Tant le cérium que le lanthane sont extraits quantitativement, bien que le cérium puisse être extrait à des valeurs de pH plus faibles.
Le type d’amine et le milieu aqueux influencent décisivement l’extraction de ces éléments. Les amines primaires (RNH2) extraient ces métaux d’un milieu sulfate, tandis que les amines tertiaires (R3N) les extraient d’un milieu nitrate.
En général, les terres rares légères sont préférentiellement extraites avec ces agents d’extraction basiques.
- TBP (phosphate de tributyle) et DBBP (di-n-butyl-n-butyl-phosphonate). Les terres rares sont extraites de différents milieux aqueux. Avec eux, on obtient l’europium et le samarium. Leur mode d’action repose sur la réaction : Ln3+aq + 3NO3– + 3Lorg < => Ln(NO3)3L3(org)
- Éthers couronne. Ils ont été utilisés pour l’extraction des lanthanides. Le (sim-dibenzocrown-16-acide oxiacétique) en solution 80:20 chloroforme – heptanol. Dans le cas des éthers couronne, l’extraction des diverses terres rares dépend très spécifiquement du pH correspondant au milieu aqueux et, ainsi, le Lu3+ est extrait quantitativement à un pH de 6,7, tandis que le La3+, Pr3+, Sm3+, Eu3+, Tb3+, Er3+ et Yb3+ le font presque quantitativement (> 98 %) à un pH de 6,5. La stœchiométrie du complexe extrait est de 1:2 (métal : agent d’extraction). Les calixarènes sont des (1,n)-cyclophanes qui présentent une cavité formée par des groupes phényles qui agissent comme des ponts, permettant également l’introduction de substituants dans le squelette organique. Cette structure a fait que ces composés ont été étudiés comme réactifs pour l’extraction de certains lanthanides trivalents (« `html
- Lantano, néodyme, europium, erbium et yttrium.
- Mélanges synergiques. Les mélanges synergiques remplacent les systèmes traditionnels d’extraction à un seul extractant. Les mélanges synergiques, c’est-à-dire la combinaison de deux ou plusieurs agents extractants qui augmentent l’efficacité de l’extraction et renforcent la spécificité de l’opération de séparation, prennent une importance particulière. Par exemple, un acide phosphonique tel que le PC-88 A (acide 2-éthylhexylphosphonique) dissous dans le n-heptane a été étudié avec le DTPA (diéthylamine-acide pentaacétique) pour l’extraction des lanthanides.
Les facteurs de séparation entre Y/Ho/Er sont plus élevés en ajoutant du DTPA, tandis que la stœchiométrie de l’espèce extraite est représentée par LnR3-3HR.
Conclusions
Les terres rares étaient, il y a quelques années, simplement la fin de la table périodique à laquelle on n’accédait pas par manque de temps ou simplement par méconnaissance. Aujourd’hui, leurs propriétés technologiques et leurs applications industrielles ont placé ces minéraux au statut de minéraux critiques pour de nombreux gouvernements.
Dans l’Ordre Présidentiel Exécutif 13817, du 20 décembre 2017, du Gouvernement des États-Unis, la vulnérabilité que représente pour un système technologique la dépendance externe de 35 minéraux classés comme minéraux critiques est reconnue, dont 17 sont des terres rares.
Ils se caractérisent par une haute conductivité électrique et des propriétés magnétiques qui les rendent optimaux pour fabriquer des batteries, des téléphones mobiles, des batteries pour véhicules électriques, des systèmes d’éclairage LED, des éoliennes, des systèmes laser, des technologies pour satellites, des systèmes de défense, etc.
Ces applications exigent une pureté dans les métaux obtenus et des traitements efficaces des concentrés. De nouvelles méthodes comme l’application des éthers couronne, l’utilisation de mélanges synergiques tels que les combinaisons d’acides alkylphosphoriques, ou l’application de sels d’ammonium quaternaires faciliteront l’optimisation du processus d’enrichissement.
Bibliographie
F.J.Alguacil et F.Rodríguez, CSIC. Processus de séparation des terres rares. Rev. Metal Madrid, 33 (3), 1997
Bautista, R.G. Mineral Proc. Extractive Met. Rev., 8, 1992 : 175-182.
Bautista, R.G. et Jackson, N. Terres rares, ressources, science, technologie et applications. TMS. Warrendale (États-Unis), 1992.
Habashi, F. Terres rares ’90. Proc. Int. Symp. on Processing of Rare Metals. Osaka (Japon), 1990 : 47-52.
Patricio Javier Avendaño Corvalán, Thèse “ÉVALUATION DE LA FAISABILITÉ TECHNIQUE ET ENVIRONNEMENTALE D’UNE USINE D’EXTRACTION DE TERRES RARES AU CHILI” Faculté du Chili, 2017
R.Sáez Puche, C.Cascales, P.Porcher, P.Maestro. “Terres rares : Matériaux avancés”. Fac. Sciences chimiques Université Complutense de Madrid. CSIC. CNRS. Recherche chimique. 2000
« `