Sections
- Caractéristiques de base du lithium
- Domaine d’application
- Recyclage de l’électronique
- Extraction et obtention de lithium
- Recyclage des batteries et récupération de lithium
- Conclusions
Caractéristiques de base du lithium
Le nom du métal lithium (du grec λίθoς -ου, (« pierre »), provient du fait qu’il a été trouvé dans un minéral, tandis que le reste des métaux alcalins a été découvert dans les tissus des plantes.
C’est Johann Arfvedson en 1817 qui a trouvé le nouvel élément dans la spodumène et la lépidolite d’une mine de pétalite, LiAl(Si2O5)2, de l’île Utö (Suède).
En 1818, C.G. Gmelin a été le premier à observer que les sels de lithium colorent la flamme d’une couleur rouge vif. Tous deux ont tenté, sans succès, d’isoler l’élément de ses sels, ce que W.T. Brande et Sir Humphrey Davy ont finalement réussi à faire par électrolyse de l’oxyde de lithium.
En 1923, l’entreprise allemande Metallgesellschaft AG a commencé à le produire par électrolyse du chlorure de lithium et du chlorure de potassium fondus.
Le lithium (Li) est le métal le plus léger, sa densité est la moitié de celle de l’eau. Comme les autres métaux alcalins, il est monovalent et très réactif, bien que moins que le sodium, ce qui fait qu’il ne se trouve pas libre dans la nature.
C’est un élément modérément abondant ; il est présent dans la croûte terrestre à 65 ppm, ce qui le place en dessous du Ni, Cu et W et au-dessus du Cr et Sn. Le Li, avec le H et le He, est l’un des seuls éléments qui ont été obtenus lors du Big Bang.
Tous les autres se sont formés par fusion nucléaire dans des étoiles de la séquence principale ou lors d’explosions de supernovae. Il a les caractéristiques physico-chimiques de base suivantes :
Densité : 535 Kg/m3
Dureté Mohs : 0,6
Apparence : Solide blanc argenté, gris
Masse atomique : 6,941
Rayon atomique : 167 pm
État d’oxydation : Base forte
Structure cristalline : Cubique centrée sur le corps
Point de fusion : 453,69 K
Point d’ébullition : 1615 K
Chaleur spécifique : 3582J/(Kg.K)
Domaine d’application
Le lithium est connu comme le pétrole blanc en raison du rôle central qu’il joue et jouera probablement dans le paysage énergétique dans les années à venir.
Ses propriétés font des ions de lithium les ingrédients parfaits pour fabriquer des batteries. En raison de sa chaleur spécifique élevée, il est utilisé dans des applications de transfert de chaleur, et en raison de son potentiel électrochimique élevé, il constitue une anode appropriée pour les batteries des voitures électriques, des smartphones et certains appareils électroniques.
Il a également les usages suivants, bien que sa consommation soit relativement faible par rapport à celle déjà mentionnée des batteries :
- Les sels de lithium, en particulier le carbonate de lithium (Li2CO3) et le citrate de lithium, sont utilisés dans le traitement de la manie et de la dépression bipolaire, bien que récemment, leur utilisation se soit étendue à la dépression unipolaire. C’est un stabilisateur de l’humeur. On pense que ses effets sont basés sur ses effets actifs sur la fonction de la sérotonine. De plus, il se trouve dissous dans le plasma sanguin et/ou dans les érythrocytes.
- Le chlorure et le bromure de lithium ont une hygroscopicité élevée, ce qui en fait d’excellents dessicants. Le second est utilisé dans des pompes à chaleur à absorption, entre autres composés comme le nitrate de lithium.
- Le stéarate de lithium est un lubrifiant général dans des applications à haute température.
- Le lithium est un agent utilisé dans la synthèse de composés organiques.
- Le hydroxide de lithium est utilisé dans les vaisseaux spatiaux et les sous-marins pour purifier l’air en extrayant le dioxyde de carbone.
- C’est un composant commun des alliages d’aluminium, de cadmium, de cuivre et de manganèse utilisés dans la construction aéronautique, et il a été utilisé avec succès dans la fabrication de céramiques et de lentilles, comme celles du télescope de 5,08 m de diamètre de Monte Palomar.
- Il a également des applications nucléaires. Les isotopes stables du lithium sont deux : Li-6 et Li-7, ce dernier étant le plus abondant (92,5 %).
Chaque année, 800 000 tonnes de batteries de voitures, 190 000 tonnes de batteries d’usage industriel et 160 000 tonnes de batteries de consommation domestique ou citoyenne entrent sur les marchés de l’Union européenne. Dans leur composition, ces batteries contiennent du lithium et d’autres métaux précieux comme le cobalt, le cuivre, etc.
Au niveau mondial, on estime que le marché des batteries au lithium générera des revenus d’environ 46,210 milliards de dollars en 2022. En raison de la tension croissante entre l’offre et la demande sur le marché, les prix du lithium ont augmenté de 47 % en 2016, et on estime que la demande augmentera de 64 % d’ici 2020.
Le problème réside dans les effets environnementaux de l’exploitation de ce minéral, tels que la pollution de l’eau, les impacts sur le paysage, l’impact sur la flore et la faune, la génération de déchets solides et chimiques… L’Argentine est très consciente de ces questions, car les autorités ont confirmé que le pays triplerait la production de lithium d’ici 2019. On s’attend à ce qu’en 2025, la production de lithium se situe entre 400 000 et 500 000 tonnes.
Recyclage de l’électronique
Le traitement et le recyclage des déchets provenant d’appareils électriques et électroniques, tels que les ordinateurs, les téléviseurs, les réfrigérateurs et les téléphones mobiles, sont aujourd’hui plus importants que jamais en raison de l’augmentation rapide de la consommation de ces produits.
L’Europe a été la deuxième région du monde à produire le plus de déchets électroniques en 2016 avec 12,3 millions de tonnes (MT), après l’Asie qui a généré 18,2 MT. Malgré la législation en vigueur, les rapports indiquent qu’à l’échelle mondiale, seulement 8,9 MT de déchets électroniques ont été collectés et recyclés. Cela équivaut à 20 % de tous les déchets électroniques générés.
Selon des sources fiables, 80 % des « déchets technologiques » générés par le premier monde sont envoyés en Afrique, tant pour approvisionner le commerce de ces produits avec des modèles d’occasion, souvent obsolètes et de très courte durée de vie, que pour alimenter des chaînes de recyclage illégales.
En fait, des métaux tels que le vanadium, le cobalt, l’arsenic, l’aluminium, le chrome, le plomb, etc., ont été trouvés dans les analyses de sang pratiquées sur des émigrants africains, dépassant les valeurs obtenues chez des personnes des pays les plus avancés technologiquement, comme le Japon ou les États-Unis.
Les auteurs soulignent un autre fait : l’Afrique peut être en retard par rapport au reste du monde en matière de lignes téléphoniques fixes, mais l’utilisation du mobile a explosé dans ses pays ces dernières années, tant dans les villes que dans les zones rurales, et 97 % des mobiles du continent sont d’occasion.
Pour toutes ces raisons, ils recommandent de suivre de plus près ce type de polluants, car certains de ces éléments présentent un énorme risque pour la santé, et parce qu’il est bien connu que la pollution ne respecte pas les frontières, de sorte que la gestion inappropriée de ces déchets technologiques dans ces pays peut entraîner une augmentation généralisée de la pollution mondiale.
Dans le recyclage des batteries de Li, le lithium lui-même qu’elles contiennent est éliminé. Cela peut sembler une incongruité, mais économiquement ce n’est pas le cas, car le prix du lithium est d’environ 6 euros par kilo, suffisamment bas pour qu’il n’existe pas de mouvement privé en faveur de son recyclage.
Actuellement, lorsque nous envoyons nos batteries au lithium à recycler, les métaux qui en sont extraits sont ceux les plus précieux, comme le cobalt. Le cobalt est utilisé dans les batteries au lithium-ion, d’où il est ensuite extrait sous forme d’oxyde de cobalt et de lithium, avec un prix de 19 euros par kilo, plus de trois fois le prix sur le marché du lithium.
En raison du faible prix du lithium, qui devrait rester stable grâce aux nouveaux gisements découverts en Bolivie, sa récupération des batteries usagées ne constitue pas un incitatif commercial, le laissant comme un simple remplissage pour le béton, rendant ainsi impossible sa future récupération et utilisation ; mais cela comporte des risques, car les batteries contiennent des acides et des alcalis qui agissent comme des électrolytes dans leur fonctionnement.
Personne ne peut garantir qu’il n’y a pas de lixiviation interne à l’intérieur des batteries (dissolution), une fois enterrées, et qui pourrait corroder le béton, car ce matériau peut être exposé à des infiltrations, des ruptures dues à des tremblements de terre, qui pourraient faire en sorte que le matériau atteigne le sol et les couches souterraines et aquifères.
Extraction et obtention de lithium
Extraction à partir de minéraux
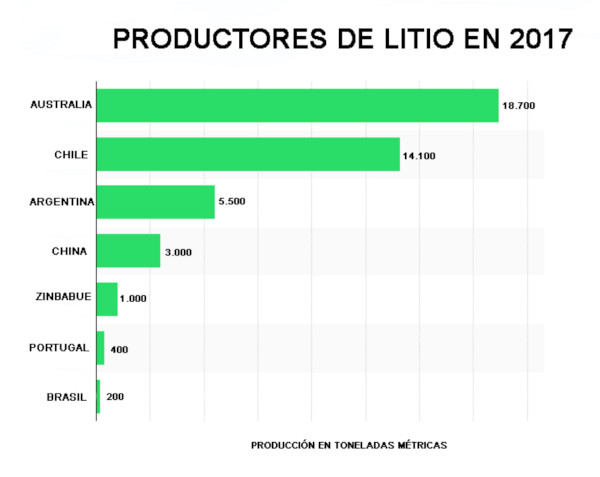
Il existe différents procédés d’extraction. L’Australie, le plus grand producteur mondial, l’obtient par le biais de l’exploitation minière conventionnelle à partir de minéraux tels que la spodumène de Greenbush, mais c’est un processus coûteux et polluant.
Le Chili, l’Argentine et la Chine, en revanche, utilisent un lent processus d’évaporation de l’eau des salines. Il est extrait de saumures où il existe sous forme de sels naturels comme dans le Salar d’Atacama au Chili ou dans celui de l’Homme Mort et d’autres en Argentine, ou de dépôts.
Une grande partie de la production mondiale de lithium provient de ces saumures, dont le coût de production est bien inférieur à celui des dépôts minéraux (selon John McNulty : 1 500-2 300 $/Tm et 4 200-4 500 $/Tm, respectivement).
Les réserves ou les ressources de lithium de la Bolivie se trouvent dans des saumures, qui ont une densité d’environ 1 200 grammes par litre (g/l), de sorte qu’une concentration de lithium de 0,1 % en poids équivaut à 1 000 parties par million (ppm) et 1,2 g/l.
L’extraction de saumures de lithium se fait par pompage et sa concentration par adsorption utilisant un adsorbant sélectif, ou par évaporation dans des bassins peu profonds construits à cet effet. L’évaporation, en plus d’augmenter la concentration des sels, fait que lorsque certains d’entre eux sont saturés, ils précipitent.
L’adsorption a l’avantage de ne pas être influencée par la composition de l’eau salée (il est possible de traiter des saumures avec de faibles concentrations de lithium comme cela se fait expérimentalement avec l’eau de mer), ni par les conditions météorologiques du lieu, et ne génère pas beaucoup de déchets, tandis que les inconvénients sont que des réactifs sont nécessaires, que l’équipement d’adsorption est coûteux et compliqué, et que le coût de l’adsorbant est élevé.
Les avantages de l’évaporation naturelle sont essentiellement qu’elle ne consomme pas d’énergie et n’utilise pas beaucoup de réactifs chimiques, tandis que ses inconvénients sont la nécessité d’utiliser simultanément un autre méthode de séparation, l’accumulation de déchets et la dépendance aux conditions météorologiques du lieu (vitesse d’évaporation et pluies).
La plus grande production mondiale de lithium à partir des saumures provient du Salar d’Atacama au Chili, où la méthode d’évaporation est utilisée et pour laquelle des données et de nombreux facteurs d’opération sont disponibles, permettant sa comparaison avec ceux du Salar d’Uyuni en Bolivie.
Les saumures d’Atacama sont plus riches en lithium que celles d’Uyuni (également en potassium et en bore), de sorte que le rapport Mg/Li, nuisible à la concentration de lithium, est de 6/1 et 19/1 respectivement.
Alors que l’évaporation et la pluviométrie sont de 3 200 mm/an et 10-15 mm/an à Atacama, à Uyuni, elles sont de 1 500 mm/an et 200-500 mm/an, ce qui signifie qu’à Uyuni, l’évaporation est moindre et la pluie beaucoup plus importante, ce qui retardera considérablement l’évaporation.
À Atacama, le processus d’évaporation qui concentre le lithium de 0,15 % à 6 % (40 fois) dure de 12 à 18 mois ; il est à prévoir qu’à Uyuni, ce processus durera beaucoup plus longtemps.
L’étude de laboratoire « Traitement chimique des saumures du Salar d’Uyuni-Potosí » réalisée en 1987 en France dans le cadre de la convention UMSA-ORSTOM (Institut français de recherche scientifique pour le développement), simulant dans 5 verres les conditions des bassins d’évaporation, a établi que le chlorure de sodium (NaCl) précipite d’abord, suivi presque immédiatement par le chlorure de potassium (KCl).
Comme le chlorure de magnésium (MgCl2) ne peut pas être séparé par évaporation, ce qui complique le processus, il est précipité sous forme d’hydroxyde de magnésium (Mg(OH)2) en ajoutant de la chaux.
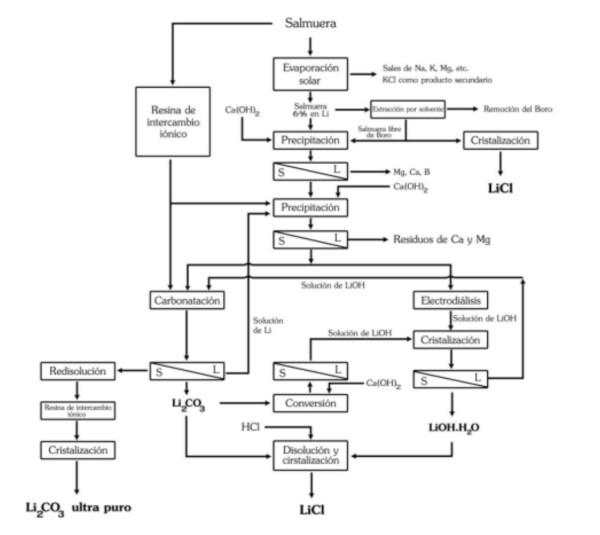
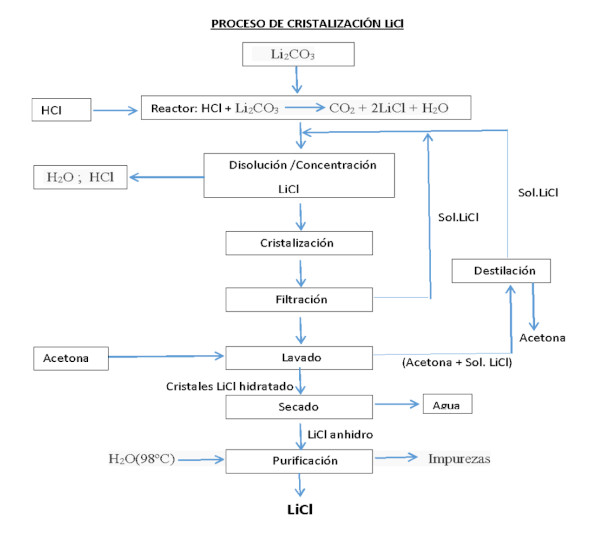
Le processus d’obtention du chlorure de lithium, à partir du carbonate ou de l’hydroxyde de lithium, peut être réalisé en réagissant avec de l’acide chlorhydrique :
Li2CO3 + 2HCl === 2LiCl + H2O + CO2
LiOH·H2O + HCl === LiCl + 2H2O
Précipitation et raffinage du carbonate de lithium (CL)
Le CL obtenu par n’importe quelle méthode doit être purifié, séché et cristallisé. Malgré la forte teneur en lithium dans le Salar d’Atacama et l’expérience dans son obtention, il est indiqué que sa récupération est de 42 %.
Le CL à utiliser dans la fabrication de batteries pour véhicules électriques doit avoir une pureté d’au moins 99,95 %, de sorte que le CL obtenu par précipitation doit être raffiné à travers plusieurs réactions et étapes de recristallisation, dans certains cas par le biais d’une résine d’échange ionique.
Étant donné que le processus de raffinage a un coût élevé et que sa récupération est moindre après chaque étape (à l’étape de raffinage, elle est estimée à environ 70 %), plus la pureté du CL est élevée, plus son prix augmente de manière significative.
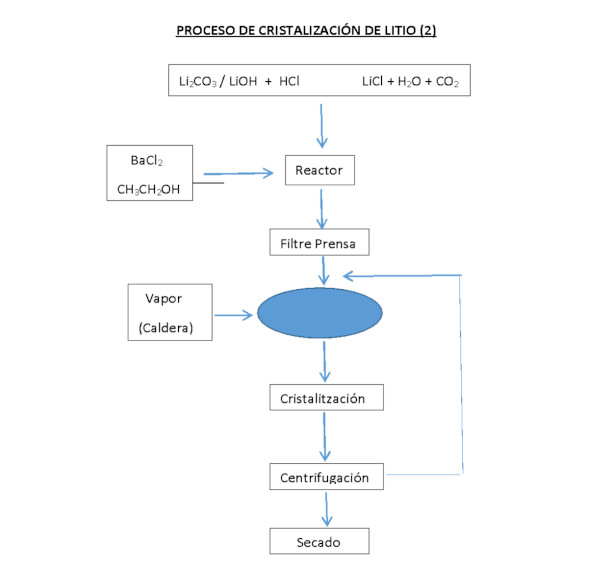
Recyclage des batteries et récupération de lithium
Conscients de la nécessité de recycler le lithium des batteries usagées et pensant à sa future rareté et à son coût croissant, certains processus ont été étudiés que nous résumons ci-dessous :
Processus Physico-Chimique
La récupération des matériaux qui composent les batteries au lithium-ion se fait par le processus de lixiviation. C’est-à-dire, par l’utilisation d’acides pour dissoudre les composants des batteries une fois le dispositif démonté.
Le processus dans son ensemble doit suivre une série d’étapes, commençant par la collecte des batteries, la classification et le déchargement de l’électricité. Ensuite, la séparation de ses composants est réalisée, jusqu’à obtenir l’anode et la cathode (parties permettant la réaction électrochimique) complètement séparées.
De cette manière, chaque partie est traitée séparément pour récupérer les matières premières de la batterie.
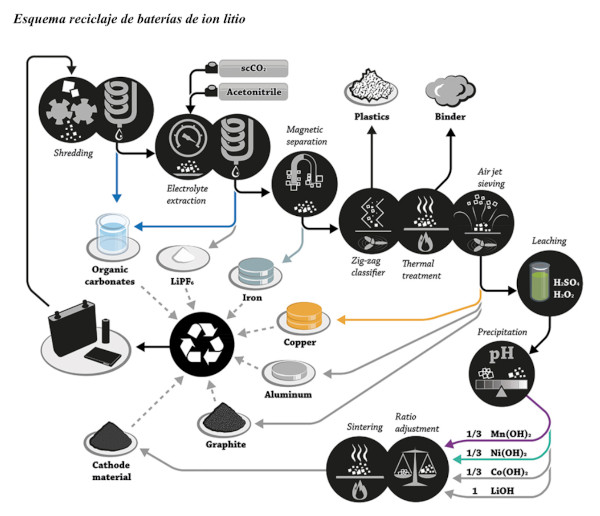
Un autre système présente une alternative pour la récupération du lithium, du cobalt, du manganèse et du nickel des batteries usagées des téléphones mobiles et des ordinateurs.
Le processus commence par le démontage manuel de ces appareils pour séparer le résidu d’intérêt, puis une réduction de taille est effectuée, atteignant entre 560 et 800 μm dans le résidu des appareils, respectivement.
L’aluminium et le cuivre sont lixiviés avec de l’hydroxyde d’ammonium pour éliminer les réactions d’interférence lors des étapes ultérieures. Le lavage filtré provenant de l’étape précédente est lixivié avec de l’acide sulfurique, et des récupérations maximales de 96,0 et 99,9 % de lithium, de cobalt, de manganèse et de nickel sont obtenues, avec des concentrations de 3,0 et 4,0 M, dans chaque type de résidu.
Le liquide acide lixivié est neutralisé avec de l’hydroxyde de sodium, du bicarbonate de sodium est ajouté et le carbonate de manganèse, l’hydroxyde de cobalt et le bicarbonate de lithium précipitent, avec les conditions nécessaires respectives.
Ensuite, on procède à l’évapo-cristallisation des produits précipités et on atteint des récupérations supérieures à 96,0 %, pour chaque métal.
Le Carbonate de Lithium (Li2CO3) est le composé de lithium le plus utilisé ; un gramme de lithium équivaut à 5,32 grammes de carbonate de lithium (CL).
Récupération électrochimique de lithium
Récemment, le chercheur argentin Ernesto Calvo propose de mettre en œuvre une technologie innovante d’extraction de lithium à grande échelle, sans générer de déchets polluants.
Pour cela, il extrait la saumure par un système de pompage pour l’introduire dans un réacteur avec deux électrodes. Celles-ci capturent sélectivement, d’une part, les ions de lithium, et d’autre part, le chlorure de la saumure, pour être restitué au salar.
Par la suite, la polarité électrique du réacteur est inversée et le processus inverse est effectué, c’est-à-dire que la saumure est retirée et une solution de récupération est incorporée, qui concentre le chlorure de lithium.
Pour ce processus, on utilise de l’énergie solaire et le chlorure de lithium extrait de la saumure forme une sorte de batterie de lithium pour stocker l’énergie renouvelable intermittente.
Membranes d’Osmose Inverse capables de séparer le lithium
Récemment, une nouvelle technologie a été développée qui permettra d’extraire le lithium de l’eau de mer, et de plus, de le faire de manière efficace, tout en produisant de l’eau potable dans le processus.
Comme nous le savons, l’eau de mer est un cocktail complexe de minéraux utiles, mais il est difficile de séparer ceux dont nous avons besoin, comme le lithium. Une équipe de scientifiques d’Australie et des États-Unis a développé une nouvelle technique de désalinisation de l’eau qui peut non seulement rendre l’eau de mer potable, mais aussi récupérer le lithium présent dans celle-ci.
La clé du processus réside dans les structures métal-organiques (MOF), qui possèdent la plus grande surface interne de tout matériau connu. Un seul gramme pourrait théoriquement couvrir un terrain de football, et c’est cette structure interne complexe qui les rend parfaits pour capturer, stocker et libérer des molécules.
Actuellement, les membranes d’osmose inverse sont la technologie la plus utilisée pour la filtration de l’eau, et elles fonctionnent de manière assez simple. Les pores de la membrane sont suffisamment grands pour laisser passer les molécules d’eau, mais trop petits pour la plupart des contaminants.
Le problème est que, pour fonctionner, ces systèmes nécessitent de pomper l’eau à une pression relativement élevée.
Les membranes MOF, en revanche, peuvent être plus sélectives et efficaces.
Des chercheurs de l’Université de Monash, de l’Organisation de Recherche Scientifique et Industrielle du Commonwealth et de l’Université du Texas ont développé une membrane de ce type.
Le design s’inspire de la « sélectivité ionique » des membranes cellulaires biologiques, ce qui permet au matériau MOF de déshydrater des ions spécifiques au fur et à mesure qu’ils passent. Mieux encore, ces filtres ne nécessitent pas la formation d’eau, ce qui permet également d’économiser de l’énergie.
« Nous pouvons utiliser nos découvertes pour relever les défis de la désalinisation de l’eau », déclare Huanting Wang, auteur de la nouvelle étude. Au lieu de s’appuyer sur les processus coûteux et énergivores actuels, cette recherche ouvre la voie à l’élimination des ions de sel de l’eau d’une manière beaucoup plus efficace sur le plan énergétique et écologiquement durable.
Ces ions de lithium sont abondants dans l’eau de mer (environ 0,17 ppm), de sorte que le développement de cette technologie pourrait avoir de grandes répercussions pour l’industrie minière qui utilise actuellement des traitements chimiques peu efficaces pour extraire le lithium des roches et des saumures.
La demande mondiale de lithium requise pour des secteurs tels que la voiture électrique est de plus en plus élevée, de sorte que ces membranes se positionnent comme une alternative efficace pour extraire le lithium de l’eau de mer, qui est une ressource abondante et facilement accessible, de sorte que son exploitation devrait également être économique.
Dans cette application, nous pouvons envisager une osmose inverse de type fermé afin de maximiser la concentration de lithium et ainsi réduire la taille et le coût du système d’évapo-cristallisation nécessaire par la suite.
Récupération sélective évaporative de lithium (LiOH)
La récupération sélective de lithium à partir de saumures avec un contenu inférieur à 1 % en présence de fortes concentrations d’autres ions alcalins et alcalino-terreux est un objectif industriel.
Les processus évaporatifs sont basés sur la solubilité différentielle des sels de lithium dans des solutions concentrées des saumures, c’est-à-dire la recristallisation fractionnée.
Alternativement, des processus chimiques et électrochimiques sélectifs pour la récupération de chlorure, d’hydroxyde ou de carbonate de lithium de haute pureté ont été conçus pour réduire les temps de processus et diminuer l’impact environnemental dû à la perte d’eau et à la formation de déchets nocifs pour l’environnement.
Récemment, une méthode rapide basée sur la précipitation de phosphate de lithium, Li3PO4 peu soluble (0,39 g/l) par traitement de saumures avec de l’acide phosphorique a été proposée ; ensuite, le phosphate de lithium insoluble est traité avec de la chaux pour former de l’hydroxyapatite très insoluble et récupérer de l’hydroxyde de lithium soluble.
3Li3PO4 + 5Ca(OH)2 → Ca5(PO4)3.OH + 9LiOH
Des processus d’extraction de lithium de ses dépôts dans les salars argentins. Dans ce processus, l’acide phosphorique est récupéré par traitement de l’hydroxyapatite avec de l’acide sulfurique, avec formation de sulfate de calcium hydraté (gypse) qui a des applications dans la construction :
Ca5(PO4)3.OH + 5H2SO4 → 5CaSO4.2H2O + H3PO4
Cette méthode a été brevetée par l’entreprise sidérurgique coréenne Posco, qui a installé une usine pilote à Cachauri, Jujuy, en 2015.
La méthode ne traite pas les saumures par évaporation, ce qui la rend significativement plus rapide que les méthodes évaporatives, cependant, en raison de l’utilisation d’acide phosphorique, qui bien qu’il soit récupéré, peut laisser des résidus de phosphates de magnésium et de calcium sous forme de boues polluantes.
Méthodes d’adsorption
L’adsorption sélective du lithium contenu dans les saumures (300-1000 ppm) et l’eau de mer (0,125 ppm) a été largement étudiée en utilisant des adsorbants tels que MnO2, TiO2, hydroxyde d’aluminium, etc.
La capture de lithium dans ces systèmes dépend de l’intercalation des ions lithium dans des réseaux non stoechiométriques de ces oxydes avec une capacité variant selon le type d’adsorbants entre 3 et 35 mg/g. Lorsqu’il est extrait de solutions riches en ions lithium comme les saumures (> 5 mg/L), des captures de > 20 mg/g peuvent être réalisées.
Conclusions
Le niveau actuel de recyclage des batteries au lithium-ion est encore limité, en dessous de 1 %, et il y a peu d’entreprises tout au long de la chaîne d’approvisionnement en Europe qui sont activement impliquées dans la récupération des métaux stratégiques présents dans les batteries.
Les fabricants doivent-ils supporter le coût du recyclage du lithium ? Ou devrions-nous, les consommateurs, payer une écotaxe pour cela ?
Quoi qu’il en soit, ce qui est évident, c’est que les techniques de recyclage de ces matériaux doivent être perfectionnées, au point de les rendre rentables et de produire un impact minimal sur l’environnement.
Nous nous dirigeons vers un monde avec une pénurie de ressources naturelles de plus en plus grande. Si nous gaspillons en plus celles qui nous sont utiles, nous arriverons à un point où nous n’en disposerons plus.
Si nous nous plaignons maintenant que les batteries sont chères avec un lithium abondant, que se passerait-il si ce métal commençait à se raréfier parce que nous l’avons enterré dans du béton ?