 Fortgeschrittene Oxidationsprozesse (AOP) sind aufgrund ihrer Effizienz bei der Neutralisierung einer Vielzahl von Schadstoffen durch die Erzeugung hochreaktiver Hydroxylradikale besonders interessant für die Wasser- und Luftbehandlung. Zu den AOPs gehört die Photokatalyse, bei der hauptsächlich Titandioxid (TiO2) als Photokatalysator verwendet wird, das in den letzten Jahren intensiv untersucht wurde. Diese neue Technologie wird heute als Konkurrent zu klassischen Reinigungstechniken angesehen. Dementsprechend findet man in der Literatur zunehmend wissenschaftliche Studien und Patente zu diesem Thema.
Fortgeschrittene Oxidationsprozesse (AOP) sind aufgrund ihrer Effizienz bei der Neutralisierung einer Vielzahl von Schadstoffen durch die Erzeugung hochreaktiver Hydroxylradikale besonders interessant für die Wasser- und Luftbehandlung. Zu den AOPs gehört die Photokatalyse, bei der hauptsächlich Titandioxid (TiO2) als Photokatalysator verwendet wird, das in den letzten Jahren intensiv untersucht wurde. Diese neue Technologie wird heute als Konkurrent zu klassischen Reinigungstechniken angesehen. Dementsprechend findet man in der Literatur zunehmend wissenschaftliche Studien und Patente zu diesem Thema.
Obwohl TiO2-Photokatalysatoren ursprünglich in der Wasserbehandlung eingesetzt wurden, hat sich in den letzten Jahren gezeigt, dass die photokatalytische Oxidation flüchtiger organischer Verbindungen (VOCs) in der Gasphase im Allgemeinen effizienter ist als in der Flüssigphase.
Kürzlich ist die Anzahl der Patente zur Luftbehandlung größer als die aller Patente für Wasserbehandlung und selbstreinigende Oberflächen. Dies zeigt das echte Interesse der Industrie an Anwendungen zur Luftreinigung.
Die Ursprünge der Photokatalyse
Der erste veröffentlichte Bericht über Photoreaktivität stammt von Renz aus dem Jahr 1921. Die erste Erwähnung des Begriffs „Photokatalyse“ im Titel wurde jedoch erst 1964 von Hauffe im Journal of Catalysis veröffentlicht. Laut Teichner et al. [1] ist es interessant zu erwähnen, dass das Konzept und der Begriff „heterogene Photokatalyse“ 1972 in Lyon eingeführt und entwickelt wurden, als auch mögliche photokatalytische Lösungen für verschiedene Umweltprobleme mit TiO2 vorgeschlagen wurden.
Die ersten Studien zur heterogenen Photokatalyse in Lyon wurden von P. Pichat und J.M. Herrmann zunächst am Institut für Katalytische Forschung (IRC) auf Umwelt- und Schadstoffanwendungen ausgeweitet. Im Jahr 1999 erhielt die Veröffentlichung von J.M. Herrmann „Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants“ die Auszeichnung als einer der zehn meistzitierten Artikel des Jahres in Catalysis Today [2].
TiO2-vermittelte Photokatalyse
Unter den verfügbaren Halbleitern, die als Photokatalysatoren verwendet werden können, gilt TiO2 allgemein als der beste derzeit verfügbare Halbleiter-Photokatalysator. Die überwiegende Mehrheit der Literatur zur Photokatalyse beschäftigt sich mit der Identifizierung der Eigenschaften, Anwendungen und Theorien zur Verwendung von Titandioxid als Halbleiter. Es gibt gute Gründe, TiO2 als bevorzugten Halbleiter zu wählen, darunter:
- Starke Oxidationskraft bei Raumtemperatur und Normaldruck.
- Hohe photokatalytische Aktivität zur Zersetzung einer breiten Palette von Umweltverschmutzungen.
- Chemische Inertheit.
- Physikalische Stabilität.
- Ungiftigkeit.
- Superhydrophilie.
- Kostengünstig und leicht verfügbar.
Es gibt bereits eine Reihe kommerzieller photokatalytischer TiO2-Produkte auf dem Markt; insbesondere Degussa P25 TiO2, das in vielerlei Hinsicht als Standard gilt und häufig als Vergleich in wissenschaftlichen Experimenten zur Bestimmung der photokatalytischen Aktivität verwendet wird.
Was ist ein Halbleiter?
Halbleitermaterialien zeichnen sich durch ihre elektronische Struktur aus, die durch die Bandtheorie der Materialien beschrieben werden kann [3]. Die Bandtheorie besagt, dass alle Materialien erlaubte elektronische Energieniveaus besitzen, die als Bänder definiert sind. Materialien werden anhand der Energielücke zwischen diesen Bändern klassifiziert, auch als Bandlücke bekannt. Abbildung 1 zeigt schematisch die Unterschiede in der elektronischen Struktur eines Isolators (sehr große Bandlücke), eines Halbleiters (kleinere Bandlücke) und eines Metalls (keine Bandlücke, sondern ein Kontinuum elektronischer Zustände im Material). Nach der Bandtheorie existiert das Valenzband als gefüllte Energieniveaus, während das Leitungsband aus verfügbaren, unbesetzten elektronischen Zuständen besteht, bis das Material thermisch oder elektronisch angeregt wird.
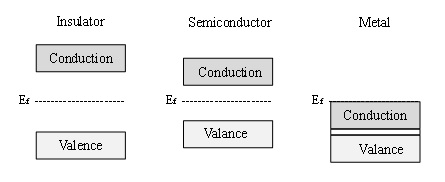 Abbildung 1. Schematische Darstellung der elektronischen Bandstruktur eines Isolators, Halbleiters und Metalls.
Abbildung 1. Schematische Darstellung der elektronischen Bandstruktur eines Isolators, Halbleiters und Metalls.
Photoanregung von TiO2
Die Bildung eines Elektron-Loch-Paares auf dem TiO2-Photokatalysator ist in Abbildung 2 dargestellt. Valenzelektronen, die für die Bindung der Atome verantwortlich sind, besetzen normalerweise das Valenzband. Elektronen, die für die elektrische Leitfähigkeit verantwortlich sind, besetzen das Leitungsband. Zwischen den beiden Bändern befindet sich eine verbotene oder elektronische Bandlücke. Dieser Bereich ist unbesetzt, da ein Elektron keinen Energiezustand in diesem verbotenen Bereich einnehmen kann. Ein Leiter hat genügend Elektronen, um auch das Leitungsband zu besetzen, während das Leitungsband bei einem Isolator im Wesentlichen leer ist. Titandioxid (TiO2) ist ein Halbleiter, was bedeutet, dass es eine schmalere elektronische Bandlücke (3,2 eV für Anatase und 3,0 eV für Rutil) als Isolatoren besitzt. Das Leitungsband wird für Elektronen aus dem Valenzband zugänglich, wenn genügend Energie für die Anregung vorhanden ist. Diese Energie ermöglicht es dem Elektron, die verbotene Lücke zu „überspringen“. Der Elektronanregungsprozess hinterlässt eine positive Ladung oder ein Loch im Valenzband. Die halbleitermittelte Photokatalyse wird durch die Verfügbarkeit dieses Elektron-Loch-Paares angetrieben, um die katalytische Reaktion zu initiieren.
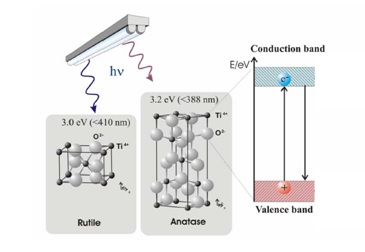 Abbildung 2. Bildung eines Elektron-Loch-Paares in TiO2 (Rutil – Anatase).
Abbildung 2. Bildung eines Elektron-Loch-Paares in TiO2 (Rutil – Anatase).
Allgemeiner photokatalytischer Reaktionsmechanismus
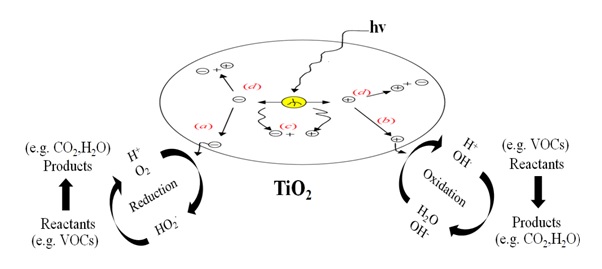 Abbildung 3. Der gesamte TiO2-Photokatalyseprozess.
Abbildung 3. Der gesamte TiO2-Photokatalyseprozess.
(a) Elektron im Leitungsband, das erfolgreich zur Oberfläche wandert, initiiert eine Reduktionsreaktion.
(b) Loch im Valenzband, das erfolgreich zur Oberfläche wandert, initiiert einen oxidativen Weg.
(c) Loch im Valenzband und Elektron im Leitungsband rekombinieren im Volumenmaterial.
(d) Loch im Valenzband und Elektron im Leitungsband rekombinieren an der Oberfläche.
Luftbehandlung durch photokatalytische Oxidation (PCO)
PCO bei der Luftreinigung umfasst kontaminierte Gase und einen Photokatalysator, der üblicherweise in immobilisierter Form vorliegt. Nachfolgend eine Zusammenfassung der Vorteile der photokatalytischen Luftbehandlung:
- Einfache Erzeugung des Photokatalysators.
- Höhere Reaktionsgeschwindigkeit im Vergleich zur flüssigen Photokatalyse.
- Fähigkeit, Abfallströme mit niedriger Konzentration und niedrigem Durchfluss bei Raumtemperatur und anderen Temperaturen und Drücken zu oxidieren.
- Gasphasenreaktionen ermöglichen die direkte Anwendung analytischer Werkzeuge zur Überwachung der Zusammensetzung, Struktur und des elektronischen Zustands des Substrats und der Adsorbate; somit können die Reaktionsmechanismen direkt aufgeklärt werden.
- Photokatalytische Reaktoren können aufgrund ihres modularen Designs, des Betriebs bei Raumtemperatur und des vernachlässigbaren Druckabfalls in neue und bestehende Heizungs-, Lüftungs- und Klimaanlagen (HLK) integriert werden. Zudem können sie an eine Vielzahl von Luftqualitätsanwendungen angepasst werden.
- Potenzielle Nutzung von Solarenergie.
Tabelle 1 fasst die Studien zur TiO2-Photokatalyse für die Luftbehandlung mit verschiedenen Gruppen organischer Schadstoffe zusammen. Die Tabelle zeigt, dass verschiedene Chemikaliengruppen ein jeweils einzigartiges Verhalten aufweisen.
Tabelle 1. PCO bei der Luftreinigung
Parameter, die den photokatalytischen Prozess beeinflussen
Ein typischer photokatalytischer Prozess ist hochkomplex, mit vielen Faktoren, die die photokatalytische Effizienz beeinflussen. Es kann zwischen intrinsischen und extrinsischen Parametern unterschieden werden. Intrinsische Parameter beziehen sich auf Eigenschaften des Photokatalysators selbst (physikalisch und chemisch). Extrinsische Parameter sind externe Faktoren wie Betriebsbedingungen. Einige dieser Parameter werden im Folgenden erläutert.
- Eingangskonzentration des Schadstoffs.
- Temperatur.
- Lichtquellen (UV-Solar).
- Katalysatorträger und Beladung.
Deaktivierung und Regeneration des Photokatalysators
Die Deaktivierung des Photokatalysators tritt auf, wenn unter längerer Versuchsdauer bei unveränderten Bedingungen eine allmähliche Abnahme der Umsetzungsrate beobachtet wird. Der Verlust der photokatalytischen Aktivität des Katalysators kann als reversibel oder irreversibel betrachtet werden. Im Allgemeinen ist die Deaktivierung irreversibel, wenn chemische Absorption auftritt, und reversibel, wenn physikalische Absorption vorliegt. Die Deaktivierung kann durch Adsorption und Anhäufung stark gebundener Nebenprodukte auf der Oberfläche verursacht werden, die die aktiven Stellen des Photokatalysators blockieren.
Ein Photokatalysator kann teilweise oder vollständig regeneriert werden, indem das System mit einem oder mehreren der folgenden Stoffe gespült wird:
- Nur Wasser.
- Reine Luft unter Beleuchtung.
- Feuchte Luft, mit oder ohne Beleuchtung.
- Luft mit H2O2, mit oder ohne Beleuchtung.
- Luft mit O3, mit oder ohne Beleuchtung.
- Reine Luft unter Beleuchtung bei erhöhter Temperatur.
Fazit
Obwohl viel Arbeit zur Photokatalyse für die Luftbehandlung geleistet wurde, ist die Umweltauswirkung von PCO auf die Luft noch nicht vollständig verstanden. In der Literatur wird die photokatalytische Leistung im Allgemeinen durch die Umwandlung des Zielschadstoffs und den Einfluss verschiedener Betriebsparameter bewertet. Es gibt wenig Informationen über die Art und den Typ der entstehenden Nebenprodukte und keine Informationen über die CO2-Mineralisierung. Diese Informationen sind entscheidend, um den Prozess zu verstehen und erfolgreiche kommerzielle photokatalytische Anwendungen zu entwickeln. Abbildung 4 zeigt den aktuellen Stand des Verständnisses bei der Anwendung der PCO-Technologie zur Lösung von Luftverschmutzungsproblemen.
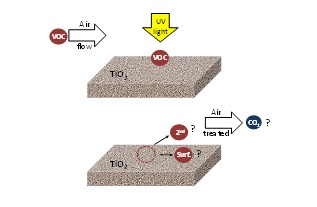 Abbildung 4. VOCs wirken auf bestrahltes TiO2: Bildung von sekundären Schadstoffen (2nd), die in die behandelte Luft wieder emittiert werden, oberflächengebundene Oxidationsspezies (surf) und CO2-Bildung.
Abbildung 4. VOCs wirken auf bestrahltes TiO2: Bildung von sekundären Schadstoffen (2nd), die in die behandelte Luft wieder emittiert werden, oberflächengebundene Oxidationsspezies (surf) und CO2-Bildung.
Literaturverzeichnis
[1] Teichner, S., The origins of photocatalysis. Journal of Porous Materials, 2008. 15(3): S. 311-314.
[2] Herrmann, J.-M., Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants. Catalysis Today, 1999. 53(1): S. 115-129.
[3] Mills, A. und S. Le Hunte, An overview of semiconductor photocatalysis. Journal of Photochemistry and Photobiology A: Chemistry, 1997. 108(1): S. 1-35.