Die atmosphärische Verschmutzung stellt in den meisten Regionen des Planeten eine ernsthafte Bedrohung für die Gesundheit dar. Laut einer von der WHO durchgeführten Bewertung der durch Umweltverschmutzung verursachten Morbidität können jährlich mehr als 7 Millionen vorzeitige Todesfälle auf die Auswirkungen der städtischen Verschmutzung zurückgeführt werden.
Die atmosphärische Verschmutzung stellt in den meisten Regionen des Planeten eine ernsthafte Bedrohung für die Gesundheit dar. Laut einer von der WHO durchgeführten Bewertung der durch Umweltverschmutzung verursachten Morbidität können jährlich mehr als 7 Millionen vorzeitige Todesfälle auf die Auswirkungen der städtischen Verschmutzung zurückgeführt werden.
Darüber hinaus ist dieses Problem nicht auf entwickelte Länder beschränkt, da mehr als die Hälfte dieser Todesfälle in der Bevölkerung der Entwicklungsländer auftritt.
Obwohl Stickstoffoxide nicht die einzigen Ursachen der atmosphärischen Verschmutzung sind, gehören sie dennoch zu den wichtigsten Schadstoffen. Stickstoffoxide sind zwei verschiedene stickstoffbasierte Gase: Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2). Der Begriff NOX bezieht sich auf die Kombination dieser beiden Gase aufgrund ihrer leichten gegenseitigen Umwandlung in Gegenwart von Sauerstoff. Formal umfasst der allgemeine Begriff Stickstoffoxide jedoch die folgenden Verbindungen: NO, NO2, N2O2, N2O4, N2O, N2O3, N2O5 und NO3, wobei letzteres instabil ist.
Obwohl der Großteil des NOX natürlich produziert wird, ist ein bedeutender Anteil des NOX auf anthropogene Prozesse zurückzuführen, wobei die wichtigsten künstlichen Quellen der Verkehr (70 %) und die Industrie (25 %) sind. Die industriellen Prozesse, die für die größte Menge an NOX verantwortlich sind, sind solche, die mit der Energieerzeugung, der Verbrennung von Kohle, Öl und Erdgas sowie Galvanik- und Metallätzprozessen zusammenhängen. NO und NO2 entstehen in Prozessen, bei denen Temperaturen über 1200 ºC in Gegenwart von atmosphärischem Stickstoff und Sauerstoff erreicht werden.
Da alle Stickstoffoxide Schadstoffe sind, hat ihre Emission besonders wichtige Auswirkungen auf die Umwelt. Die Hauptwirkungen, für die sie verantwortlich sind, umfassen:
- Zerstörung der stratosphärischen Ozonschicht.
- Beitrag zum Treibhauseffekt.
- Bildung von saurem Regen.
- Entstehung von photochemischem Smog.
Daher ist es vor allem wichtig, ihre Produktion zu minimieren und anschließend die Stickstoffoxide zu eliminieren, deren Entstehung nicht verhindert werden kann. Das Ziel der Minimierung ihrer Entstehung kann durch drei verschiedene Strategien erreicht werden:
- Reduzierung der Arbeitstemperatur.
- Verringerung der Verweilzeit der Gase, insbesondere des Stickstoffs, in der Verbrennungszone, in der die höchsten Temperaturen herrschen.
- Verringerung des Sauerstoff/Kraftstoff-Verhältnisses – die NOX-Bildung nimmt bei Reduzierung des Sauerstoffüberschusses deutlich ab.
Da es jedoch unmöglich ist, die Entstehung von Stickstoffoxiden vollständig zu verhindern, müssen Techniken eingesetzt werden, die das erzeugte NOX entfernen, um die zunehmend strengeren gesetzlichen Vorgaben einzuhalten. Die am häufigsten verwendeten Techniken zu diesem Zweck sind folgende:
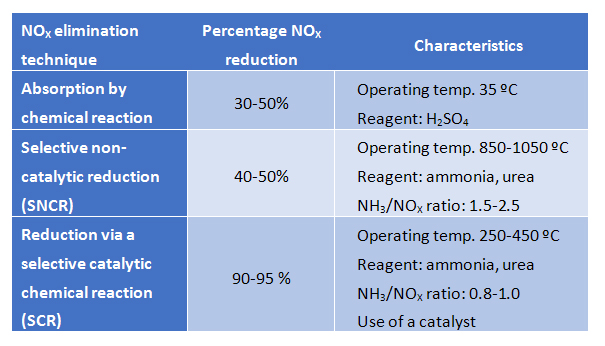
Absorption durch chemische Reaktion
Diese Technik beinhaltet die Absorption von NOX durch eine chemische Reaktion in der flüssigen Phase. Das am weitesten verbreitete Reagenz für die Absorption ist Schwefelsäure, die mit Stickstoffoxiden reagiert und HSO4NO (Nitrosylschwefelsäure) bildet, das in der flüssigen Phase verbleibt. NOX wird in der flüssigen Phase bei hohem Druck (2 atm) und niedriger Temperatur (35 ºC) absorbiert. Der Prozess kann jedoch bei hoher Temperatur (180 ºC) und niedrigem Druck (0,5 atm) umgekehrt werden, unter diesen Bedingungen kann das stickstoffhaltige Molekül (jetzt Salpetersäure aufgrund des Vorhandenseins von Wasser) von der Schwefelsäure getrennt werden, die wiederverwendet werden kann.
Der Hauptnachteil dieses Verfahrens besteht darin, dass korrosive und schädliche Chemikalien verwendet werden müssen und ein physischer Raum für den Prozess erforderlich ist. Da die erzielten Wirkungsgrade nicht hoch sind, wird diese Technik im Allgemeinen nur für niedrige NOX-Belastungen empfohlen.
Selektive nicht-katalytische Reduktion (SNCR)
Diese Technik ermöglicht die Reduzierung von Stickstoffoxidemissionen durch Umwandlung in Stickstoffgas mittels einer nicht-katalytischen chemischen Reaktion. Damit diese Umwandlung ohne Katalysator stattfinden kann, muss die Temperatur auf 850 bis 1100 ºC erhöht werden. Die Betriebstemperatur hängt direkt vom verwendeten Reduktionsmittel ab, wobei Ammoniak und Harnstoff am gebräuchlichsten sind.
Diese Technik wird meist in kleinen Industrieöfen eingesetzt, da die Kosten für den Betrieb in diesem Temperaturbereich bei größeren Anlagen deutlich steigen. Die SNCR-Anlage benötigt wenig Platz und ist einfach zu installieren und zu betreiben. Die erzielte Reduktionseffizienz ist jedoch nur moderat, weshalb diese Technik für Fälle mit niedrigen Stickstoffoxidemissionen geeignet ist.
Reduktion durch selektive katalytische chemische Reaktion (SCR)
Diese Technik basiert auf einem katalytischen Prozess, bei dem Stickstoffoxide selektiv in Gegenwart eines Katalysators reduziert werden, während das Reduktionsmittel (Ammoniak oder Harnstoff) zu Stickstoffgas oxidiert wird. Da die Reaktion auf der Oberfläche eines Katalysators stattfindet, liegt die erforderliche Temperatur im Bereich von 250-450 ºC. Die endgültige Betriebstemperatur hängt jedoch von verschiedenen Faktoren ab, wobei der verwendete Katalysator einer der wichtigsten Parameter ist.
Praktisch kann das Reduktionsmittel eine wässrige Ammoniaklösung, flüssiges Ammoniak oder eine wässrige Harnstofflösung sein. Von diesen ist die Verwendung von flüssigem Ammoniak die kostengünstigste Option, was zu niedrigeren Betriebskosten führt. Flüssiges Ammoniak ist jedoch aufgrund seiner Eigenschaften wesentlich komplexer zu handhaben als wässrige Ammoniak- oder Harnstofflösungen. Die Verwendung, Lagerung und der Transport von flüssigem Ammoniak unterliegen der Richtlinie 96/82/EG (Seveso-II-Richtlinie) und müssen gemäß einem strengen Sicherheitsprotokoll erfolgen, da es aufgrund seiner stark korrosiven Natur und seiner Explosionsgefahr in Gegenwart von Sauerstoff Risiken birgt.
Betriebstechnisch führen höhere NH3/NOX-Einspeiseverhältnisse zu einer höheren Effizienz. Allerdings steigt auch die Menge an unreaktiertem Ammoniak, die im Gasstrom verloren geht. Dieser Verlust an unreaktiertem Ammoniak muss minimiert werden, da es mit SO3 in Gegenwart von Wasser Ammoniumbisulfat (NH4HSO4) bildet, das korrosiv ist und die Anlagen verschmutzt. Der Schlüssel zum optimalen Betrieb besteht darin, das Ammoniak in einer Rate zuzuführen, die eine gute Ausbeute bei minimalem unreaktiertem Ammoniak gewährleistet.
Die Wahl des Katalysators ist entscheidend für den Prozess, da sie wichtige Parameter wie Betriebstemperatur und Reaktionsumfang beeinflusst. Vier verschiedene Materialien werden als Katalysatoren verwendet:
- Metalloxide (von Vanadium, Wolfram, Molybdän und Chrom) auf einem Träger aus Titandioxid (TiO2).
- Zeolithe.
- Eisenoxide, beschichtet mit einer dünnen Schicht aus Eisenphosphat.
- Aktivkohle.
Die Wahl des Katalysators beeinflusst auch direkt die Betriebskosten, da nicht alle die gleichen Eigenschaften, Kosten und Lebensdauer besitzen.
Die Hauptvorteile der SCR-Technologie sind die sehr hohe NOX-Eliminationsrate und die Tatsache, dass NOX in Stickstoffgas umgewandelt wird, ohne dass zusätzliche Nebenprodukte oder Rückstände entstehen.
Die wichtigsten Unterschiede zwischen den oben beschriebenen NOX-Eliminationstechniken sind in der folgenden Tabelle zusammengefasst.
Zusammenfassend muss die Stickstoffoxidemission kontrolliert werden, da sie durch die aktuelle Gesetzgebung streng geregelt ist. Der erste Schritt dieser Kontrolle besteht darin, die Produktion dieser Gase zu minimieren. Anschließend muss die nicht vermeidbare Produktion vor der Freisetzung in die Atmosphäre zusammen mit den anderen Gasen korrekt behandelt werden. Die effizienteste Technik zur Eliminierung von NOX ist die Reduktion durch selektive katalytische chemische Reaktion (SCR).