Abschnitte
- Hintergrund
- Einführung
- Prozessbeschreibung
- Anwendungsbereiche von Ammoniumsulfat
- Physikalische und chemische Eigenschaften von Ammoniumsulfat
- Schlussfolgerungen
Hintergrund
Viele Industrien erzeugen Abwässer mit hohen potenziellen Schadstoffbelastungen. Diese Abwässer müssen vor der Einleitung in die Umwelt unter geeigneten Bedingungen gemäß der geltenden Gesetzgebung (z. B. Wasserrecht) komplexen und kostenintensiven Prozessen unterzogen werden. Außerdem entstehen bei dem Prozess üblicherweise erhebliche Mengen an Abfall, die je nach ihren Eigenschaften auf speziellen Deponien entsorgt werden müssen; was zu hohen Kosten für Ausrüstung, Verwaltung, Reagenzien sowie entsprechende Gebühren und Steuern führt.
Die Behandlung von getrennt eingeleiteten Abwässern bietet gegenüber der integrierten Behandlung mit den übrigen Abwässern eine Reihe von Vorteilen. Dies liegt daran, dass viele der Waschflüssigkeiten Salze oder Prozessrückstände enthalten, die wiederverwendet werden können oder Nebenprodukte liefern, die innerhalb oder außerhalb der produzierenden Industrie verwendet werden können.
Diese Studie betrachtet den konkreten Fall eines Abwassers, das von einem Papierunternehmen erzeugt wird, welches einen bedeutenden Teil dieses Abwassers in ein Produkt umwandelt, das es selbst verwendet, sowie in ein Nebenprodukt, das auf dem Markt nachgefragt wird. Somit wird neben der Optimierung der Prozesse auch das Ziel der Null-Einleitung näher erreicht.
Einführung
Dieses Unternehmen erzeugt mehrere Abwässer; zu den bedeutendsten gehören: eines, das eine Restmenge (1-3 %) an H2SO4 enthält, ein weiteres mit hohem NH3-Gehalt (5 %) und ein weiteres mit NaOH in einer Konzentration von etwa 1 %. Es gibt auch andere Kreislauf- und Prozesswaschungen mit hohem organischem Gehalt, die einer Oxidation unterzogen werden.
Gleichzeitig verbraucht diese Industrie (NH4)2SO4 und befindet sich in einem landwirtschaftlichen Gebiet, das Düngemittel nachfragt. Im Labor wurden mehrere Tests mit den verschiedenen Fabrikabwässern durchgeführt und nach der Trennung derjenigen mit dem saubersten H2SO4, derjenigen mit NH3 und der alkalischsten (reich an NaOH) wurde ein (NH4)2SO4-Produktionssystem geplant und entwickelt.
Prozessbeschreibung
Die erste Stufe bestand darin, eine Anlage einzurichten, um ein viskoses Flüssigprodukt mit 2-3 % Gewichtsanteil herzustellen, nachdem H2SO4 und NH3 in einem Tank reagiert wurden.
2 NH3 + H2SO4 <——–> (NH4)2SO4
Die Rückgewinnungsrate der Säure betrug 2 m3/h mit einer durchschnittlichen Konzentration von 2 %, was einem Beitrag von 40 kg/h H2SO4 entspricht, was 40/98 = 0,41 kmol H2SO4 entspricht. Basierend auf molaren Äquivalenten für die Reaktionen wäre die benötigte Menge an NH3 2 x 0,41 x 17 = 13,94 kg, was bei einer Verdünnung auf 5 % einem Durchfluss von ca. 13,94/0,05 = 0,28 m3/h Ammoniakabwässern entspricht.
Die Ammoniaklösung hatte einen pH-Wert von 9,5-10 und um einen signifikanten Teil des NH3-Gases zu trennen, musste der pH-Wert auf 12,5-13 erhöht werden. Dies wurde durch die NaOH-Abgabe (pH 14 und ungefähre Konzentration von 10 kg/m3, d. h. 1 %) erreicht. Somit wurde der gewünschte pH-Wert von 13 mit einem ungefähren Durchfluss von 1,5 m3/h dieses Abwassers erzielt.
Daraus ergibt sich, dass die produzierte Menge an (NH4)2SO4 0,41 x 132 = 54,12 kg/h beträgt. Da dies bei einem Durchfluss von 2,015 m3/h erfolgte, würde die Konzentration dieses Produkts etwa 2,68 % (54,12/2015) betragen.
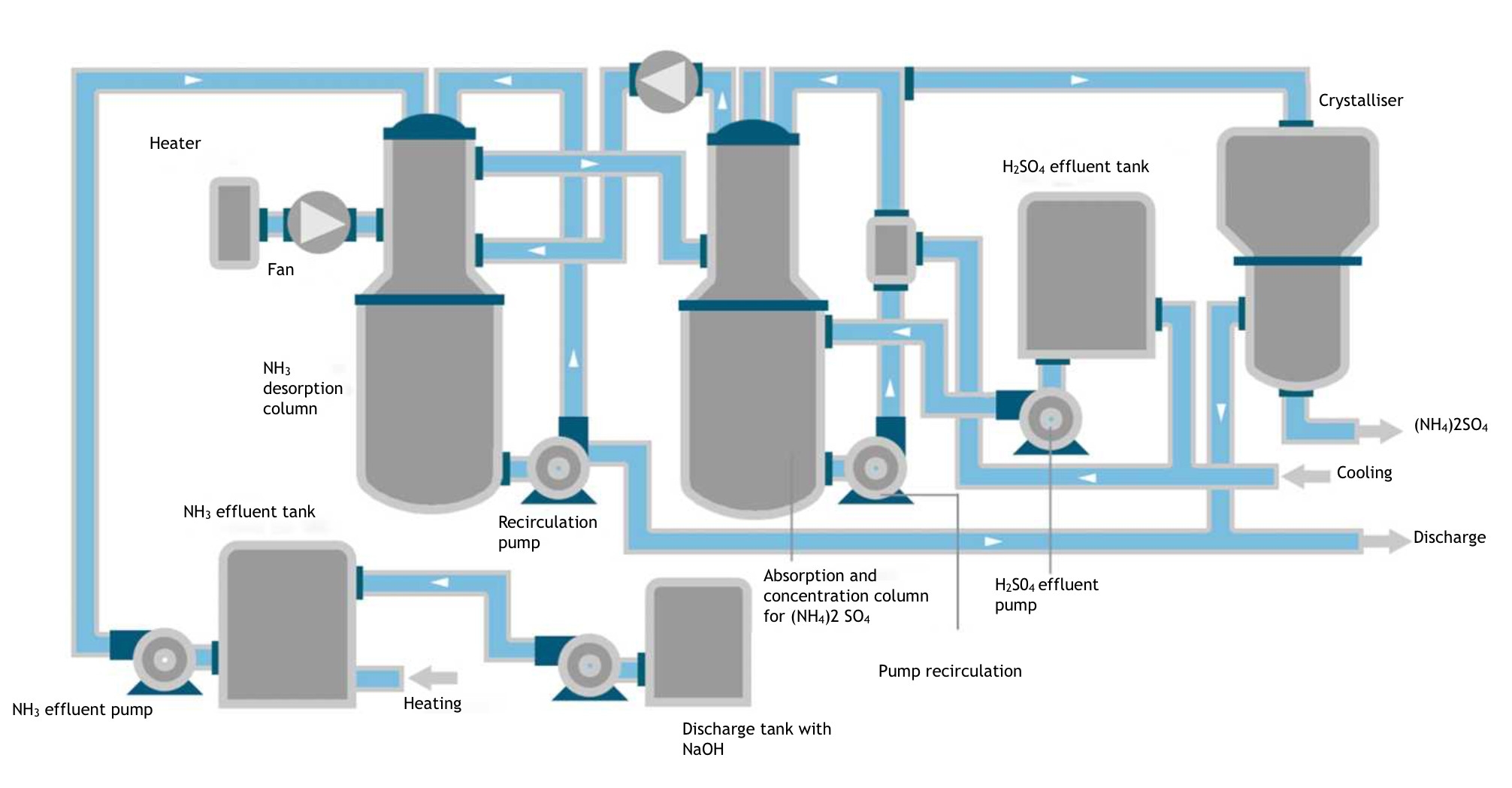
Das beigefügte Diagramm zeigt die erforderlichen Tanks für die Ammoniak-, Säure- und alkalischen Abwässer.
Das alkalische Abwasser wurde in den Ammoniak-Abwassertank gepumpt und gerührt, bis ein pH-Wert von 12,5-13 erreicht wurde, gemessen mit einem pH-Meter. Im Tank wurde die Temperatur auf etwa 40 °C erhöht, um die Desorption des NH3 zu erleichtern. Von hier aus wird es zu einem Strippungsturm gepumpt, der mit einer hochoberflächenaktiven Füllung ausgestattet ist, durch die die Ammoniaklösung gegenläufig zirkuliert, sowie einem Luftstrom von einem elektrischen Ventilator mit elektrischem Heizer, um die Abtrennung des entstehenden NH3 zu erleichtern. Die Lösung wird mit einer Pumpe in den oberen Bereich des Turms zurückgeführt.
Das NH3 wird von der Luft aus dem oberen Teil der Desorptionssäule in den unteren Teil der angehängten Absorptionssäule mitgerissen, in die das H2SO4-Abwasser aus dem Säureabwassertank gepumpt wird. Um die Absorption zu erleichtern, wird die Flüssigkeit im Tank unter der Absorptionssäule durch einen Kühler auf etwa 5 °C heruntergekühlt. Von diesem Tank wird die saure Lösung in den oberen Bereich des Absorptionsturms gepumpt, wo sie gegenläufig zum aufsteigenden Gas durch die darin enthaltene Füllung zirkuliert.
Das überschüssige Gas kann mit einem weiteren elektrischen Ventilator zum ursprünglichen Desorptionsturm zurückgeführt werden, um eventuell verbleibendes NH3 zu nutzen. Das verbleibende Gas wird nach der Behandlung durch den entsprechenden Filter ins Freie abgegeben.
Das alkalische Abwasser, aus dem der Großteil des NH3 extrahiert wurde, wird zur Abwasserbehandlungsanlage geleitet.
Die zweite Stufe besteht darin, ein konzentrierteres und marktfähiges Produkt durch Behandlung in einem Kristallisator zu erhalten, in dem ein Produkt von guter Qualität gewonnen wird.
Weitere Informationen zum Prozess
Die verwendeten Materialien müssen korrosions- und verschleißfest sein. Für die Säulen werden HDPE oder GFK mit einer inneren Vinylesterbeschichtung empfohlen. Der Einsatz von Metallteilen in den Türmen, Pumpen und insbesondere im Säurekreislauf sollte vermieden werden. Die Pumpen sollten magnetisch angetrieben und aus PP gefertigt sein. Das Pumpenlaufrad neigt zu Abriebverschleiß. Für den Kristallisator wurde rostfreier Stahl mit hoher Korrosionsbeständigkeit wie 316L oder 904L gewählt.
Um die Kristallisation von Salzen in der Füllung, dem Tank und den konzentrierten Produktkreisläufen zu verhindern, sollten diese in Umlauf gehalten werden, wenn die Anlage nicht in Betrieb ist.
Die Füllkörper für die Türme (insbesondere den Absorptionsturm) müssen leicht zur Reinigung entfernbar sein.
Anwendungsbereiche von Ammoniumsulfat
1. Verwendung in der Landwirtschaft
(NH4)2SO4 wird direkt in der Landwirtschaft als ausgezeichneter „Start-“ oder „Basis“-Dünger während der Pflanzung verwendet. Es kann auf allen Bodentypen und Kulturen eingesetzt werden, in kontrollierter Freisetzung (sofortige Wirkung und langanhaltender Effekt) und besitzt gute Lagerfähigkeit. Da es ein Dünger mit hohem Stickstoff- und Schwefelgehalt ist, verändert Calcium den pH-Wert des Bodens, in den es eingebracht wird, leicht, sodass Calcium vom Anbau optimal genutzt wird. Seine Fließfähigkeit und chemische Stabilität sind ausgezeichnet, was die Herstellung von Düngemittelformeln in physikalischen Mischungen und deren mechanische manuelle Anwendung fördert.
Stickstoff und Phosphor beeinflussen das Wachstum und die Entwicklung von Laub, Wurzeln und Stängeln sowie die optimale Entwicklung von Mikroorganismen; Schwefel ist Bestandteil der Aminosäuren in Proteinen.
Calcium beeinflusst die Produktqualität und die Widerstandsfähigkeit von Früchten gegen Schädlingsschäden. Granuliertes Ammoniumsulfat geht aufgrund der Absorption des Ammoniums durch Boden-Kolloide und seiner kontrollierten Zersetzung nicht durch Auswaschung verloren.
2. Industrielle Verwendung
(NH4)2SO4 ist in der Industrie stark nachgefragt. Es ist in Klebstoffen, Kunststoffen, Harzen, Druckfarben, Pharmazeutika sowie in Ausrüstungen für Textil-, Papier- und Metallindustrie und der Backwarenindustrie enthalten. Es wird auch in der Tierfutterherstellung eingesetzt sowie bei der Produktion von Kosmetika und Farben. Zudem wird es für die Herstellung pharmazeutischer Produkte verwendet.

Physikalische und chemische Eigenschaften von Ammoniumsulfat
Physikalische Eigenschaften
Im reinen Zustand besteht es aus weißen, diamantförmigen Kristallen (Lamellen und Agglomeraten), im Handelszustand als Dünger ist es aufgrund von Arsensulfid (aus Kokereien) leicht gelblich.
Dichte: Im reinen Zustand beträgt sie 1,77, landwirtschaftliches Ammoniumsulfat hat eine scheinbare Dichte ohne Verklumpung von 0,8 bis 1,1.
Löslichkeit: Es ist sehr gut in Wasser löslich, wobei die Löslichkeit mit steigender Temperatur deutlich zunimmt. Die Löslichkeit von Ammoniumsulfat in kg/L Wasser bei verschiedenen Temperaturen beträgt: 70,6 bei 0 °C; 74,4 bei 20 °C; 88,0 bei 60 °C; und 103,8 bei 100 °C.
Hygroskopizität: Typischerweise ist die Hygroskopizität von Ammoniumsulfat nicht sehr hoch, obwohl es kritisch ist, dass die atmosphärische Feuchtigkeit unter 70 % liegt; sie kann jedoch ansteigen, wenn freie Schwefelsäure vorhanden ist, die eine große Affinität zu Wasser hat. Hygroskopizitätsindex bei 30 °C = 20.
Schmelzpunkt: 280 °C
Dampfdruck: 1,871 kPa bei 20 °C
Reaktion des Düngers: Sauer. Versauerungsindex = 110
Salzgehalt: Salzindex = 69
Chemische Eigenschaften
Diese ergeben sich aus der Wirkung einer starken Säure (Schwefelsäure) auf eine schwache Base (Ammoniak). Dies erklärt, warum ihre Lösungen teilweise hydrolysiert und leicht sauer sind. Aus demselben Grund wird beim Erhitzen Ammoniak freigesetzt. Ammoniumsulfat kann explosive Gemische mit starken Oxidationsmitteln wie Chloraten bilden.
Bei erhöhter Temperatur wird NH3 freigesetzt. Es zersetzt sich leicht bei Raumtemperatur mit alkalischen Produkten unter Ammoniakbildung.
Handelsprodukte
Landwirtschaftliches Ammoniumsulfat ist kommerziell erhältlich in Form von:
Synthesesulfat, 21 % N
Rückgewinnungssulfat: 20,5-20,8 % N
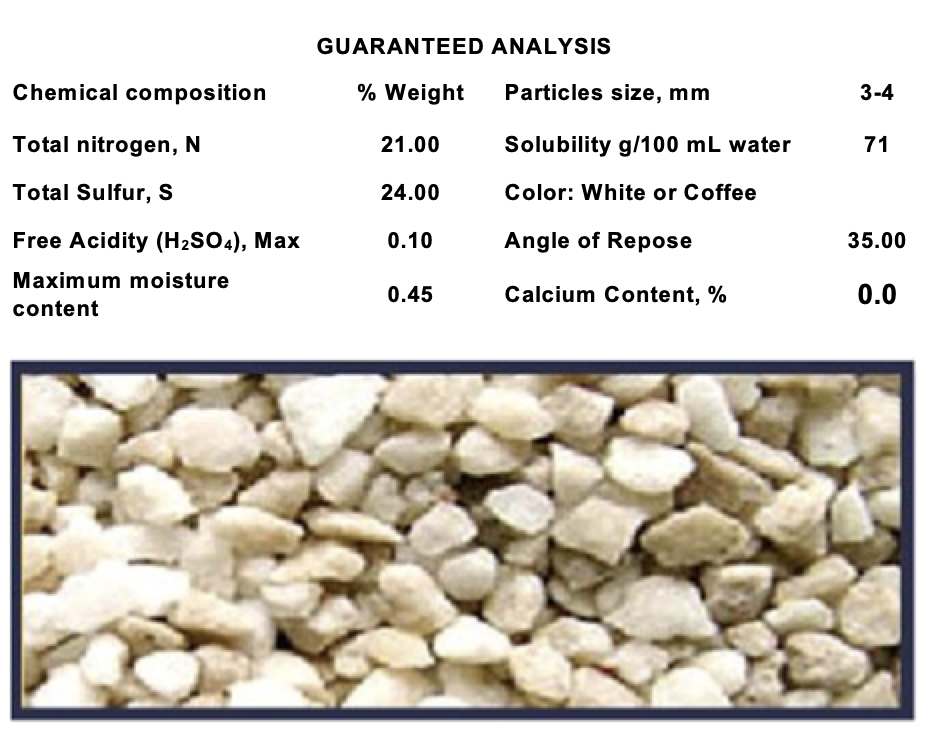
Produktdatenblatt
Schlussfolgerungen
Auch wenn es wie eine Binsenweisheit erscheint, gibt es kein besser behandeltes oder umweltfreundlicheres Abwasser als eines, das nicht eingeleitet wird. Zudem können in vielen Fällen bestimmte Abwässer die Gesamtabwässer der Fabrik stark beeinflussen. Selbst wenn sie ein geringes Volumen darstellen, können ihre Konzentration, Toxizität oder Schadstoffbelastung im Verhältnis zu den übrigen zu reinigenden Abwässern hoch sein. In solchen Fällen sollten sie getrennt und separat behandelt oder an eine Behandlungsanlage weitergeleitet werden. In jedem Fall sollten sie volumenmäßig reduziert werden, um Transportkosten zu minimieren oder sogar mit Feststoffen entfernt zu werden. Dies wird durch mechanische Mittel (z. B. Pressfilter, Zentrifugen oder Bandfilter) oder durch energiearme Verdampfung (z. B. Vakuumverdampfer oder Thermokompression) erreicht. Obwohl diese Prozesse teuer sind, bieten sie meist mittelfristig eine Amortisation, da die allgemeine Reinigung der Fabrik einfacher sein kann und die Installations- und Betriebskosten ebenfalls niedriger sind, während vor allem das Risiko einer Umweltverschmutzung minimiert wird.
Was könnte eine bessere Lösung sein, als diese Abwässer wiederzuverwenden? Dies verkürzt die Amortisationszeit für Investitionen und Betrieb erheblich. Der in diesem Artikel beschriebene Fall ist ein klares Beispiel dafür.
Bibliographie
- Chemical Engineering Manual (Band I), 6. Auflage
- Chemical Engineering Components (Vian Ocón)
- https://quimica.laguia2000.com/general/sulfato-de-amonio (Sept. 2010)
- Universitätsbibliothek – Universität Oviedo