Sezioni
- Antefatti
- Basi di partenza
- Descrizione del processo
- Campi di applicazione del solfato di ammonio
- Proprietà fisico-chimiche del solfato di ammonio
- Conclusioni
Antefatti
In molte industrie si producono effluenti che contengono elevati potenziali di cariche inquinanti per l’ambiente; questi effluenti devono essere sottoposti a processi complessi e costosi per poterli scaricare in condizioni adeguate secondo la legislazione vigente (Legge sulle Acque) e inoltre si generano spesso quantità importanti di rifiuti che devono essere inviati a una discarica specifica in base alla loro caratterizzazione, con il risultato di elevati costi di impianti, gestione, reagenti e i corrispondenti canoni e tasse.
Il trattamento degli scarichi segregati apporta una serie di vantaggi rispetto al trattamento integrato con il resto degli effluenti, poiché, in molti casi, si scartano risciacqui che contengono sali o residui di processi che possono essere riutilizzati, oppure che possono servire per ottenere sottoprodotti con utilità all’interno o all’esterno dell’industria che li genera.
Il presente studio prende come esempio uno scarico reale generato da un’industria cartaria, che riesce a convertire una parte importante dei suoi effluenti in un prodotto di utilità propria e un sottoprodotto per il quale esiste domanda sul mercato, come il solfato di ammonio. In questo modo, oltre a ottimizzare i propri processi, si avvicina maggiormente al desiderato scarico zero.
Basi di partenza
Nell’industria menzionata si generano vari scarichi, tra cui spiccano: uno che contiene un residuo di H2SO4 all’1 – 3 %, un altro scarico ricco di solfato di ammonio, o NH3, (5%) e uno scarico di NaOH con una concentrazione dell’ordine dell’1%; inoltre esistono altri effluenti provenienti da lavaggi di circuiti e da processi con alta carica organica che vengono sottoposti a ossidazione.
D’altra parte, questa industria consuma (NH4)2SO4 e si trova in un contesto di ricchezza agricola che richiede fertilizzanti. Con questo approccio, sono stati effettuati diversi test in laboratorio con i vari effluenti della fabbrica e, dopo aver segregato quelli di H2SO4 più puliti, quelli contenenti NH3 e quelli più alcalini (ricchi di NaOH), è stato progettato e sviluppato un sistema di generazione di (NH4)2SO4.
Descrizione del processo
In una prima fase, è stato predisposto un impianto destinato a formare un prodotto con una concentrazione in peso del 2 – 3 %, di aspetto liquido viscoso che si otteneva facendo reagire H2SO4 e NH3 in un serbatoio.
2 NH3 + H2SO4 <——–> (NH4)2 SO4
La portata dello scarico acido recuperato era di 2 m3/h con una concentrazione media del 2%, che rappresentava un apporto di 40 Kg /h di H2SO4, equivalente a 40/98 = 0,41 kmol di H2SO4. Poiché le reazioni avvengono mol per mol, la quantità di NH3 necessaria sarebbe di 2 x 0,41 x 17 = 13,94 Kg, che essendo diluito al 5 %, avrebbe una portata di: 13,94/0,05 = 0,28 m3/h di effluente ammoniacale, approssimativamente.
La soluzione ammoniacale aveva un pH di 9,5 – 10, e per poter separare una parte significativa di NH3 gassoso, è necessario elevare il pH fino a 12,5 – 13, cosa che si ottiene con lo scarico di NaOH che è a pH 14 con una concentrazione dell’1 % (circa 10 Kg/m3 di NaOH); così con una portata approssimativa di 1,5 m3/h di questo scarico, si raggiunge il valore di pH 13 desiderato.
Secondo questo bilancio, la quantità di (NH4)2SO4 prodotta sarebbe di 0,41 x 132 = 54,12 Kg/h, che essendo in una portata di 2,015 m3/h, la concentrazione di questo prodotto risulta essere di circa il 2,68 %, (54,12 /2015).
Come si può osservare nel diagramma allegato, sono previsti serbatoi per l’effluente ammoniacale, l’effluente acido e quello alcalino.
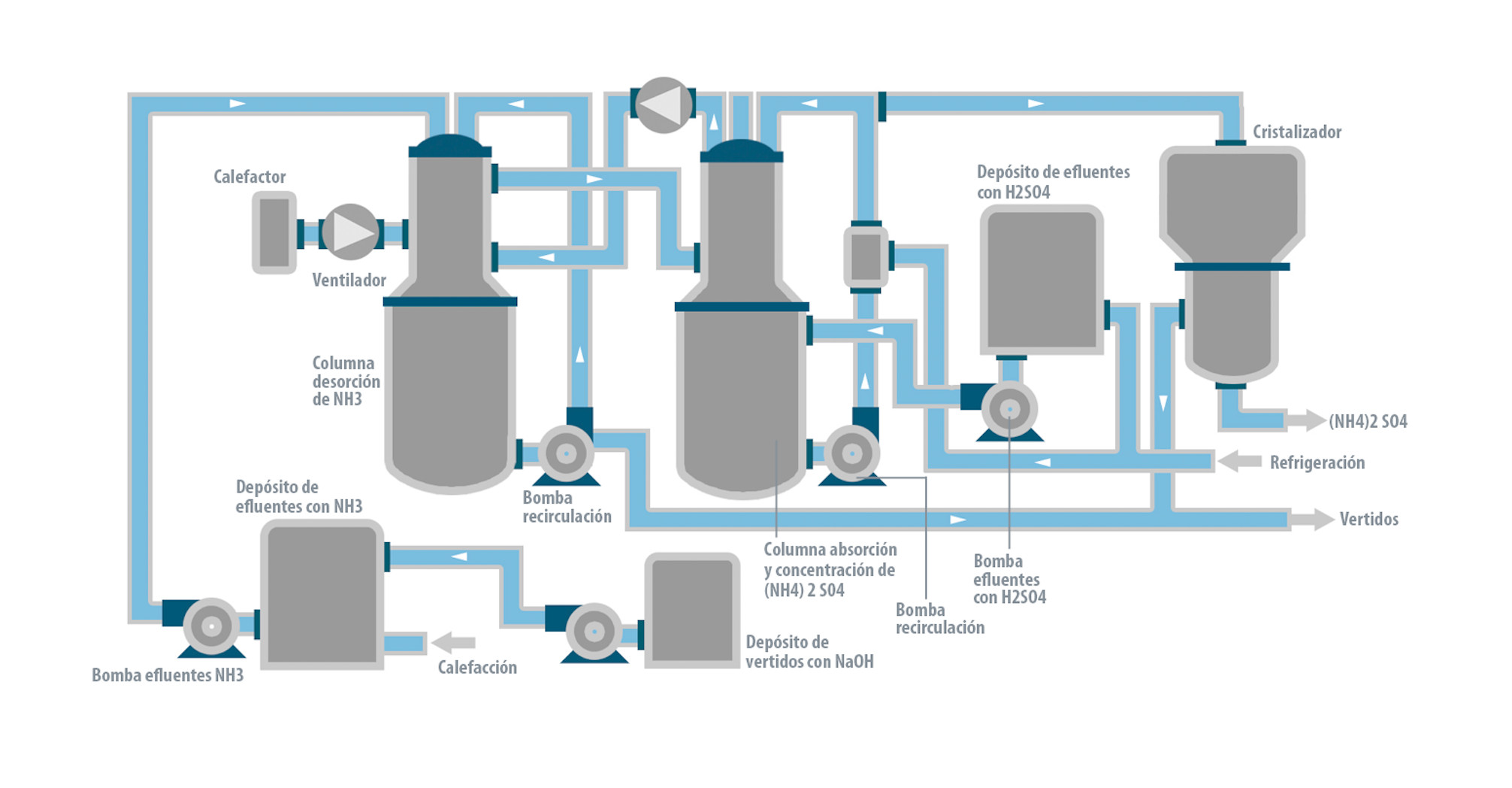
Lo scarico alcalino viene immesso nel serbatoio degli scarichi ammoniacali al fine di ottenere un pH 12,5- 13, cosa che si ottiene con una pompa, un sistema di agitazione e un pH-metro. All’interno del serbatoio la temperatura viene aumentata fino a circa 40 ºC per facilitare la desorbimento di NH3. Da qui viene pompato a una torre di stripping che contiene un riempimento ad alta superficie, attraverso il quale circolano in controcorrente la soluzione ammoniacale alcalina, e il flusso d’aria proveniente da un elettroventilatore che incorpora una resistenza elettrica per il riscaldamento, facilitando così la separazione dell’NH3 risultante. La soluzione viene ricircolata con una pompa fino alla zona superiore della torre.
L’NH3 viene trascinato dall’aria dalla zona superiore della colonna di desorbimento fino alla parte inferiore della colonna di assorbimento annessa, nella quale viene immesso l’effluente di H2SO4, tramite un gruppo di pompaggio che aspira dal serbatoio dell’effluente acido. Per facilitare l’assorbimento, il liquido contenuto nel serbatoio posto sotto la torre di assorbimento viene raffreddato fino a una temperatura di circa 5 ºC mediante un refrigeratore. Da questo serbatoio aspira un gruppo di pompaggio che ricircola la soluzione acida sulla zona alta della torre di assorbimento in controcorrente con il gas che sale attraverso il riempimento contenuto in essa.
Il gas in eccesso può essere restituito alla torre di desorbimento iniziale con un altro elettroventilatore per il possibile recupero dell’NH3 residuo. Il gas rimanente viene inviato all’esterno dopo il trattamento mediante il filtro adeguato.
L’effluente alcalino dal quale è già stata estratta la maggior parte dell’NH3, viene inviato all’impianto di depurazione degli scarichi.
In una seconda fase, e pensando di ottenere un prodotto più concentrato e commercializzabile, è stato effettuato il trattamento in un cristallizzatore che permetteva di ottenere un prodotto di buona qualità.
Osservazioni sull’impianto
I materiali devono essere resistenti alla corrosione e all’abrasione. Si raccomanda PEHD o PRFV con pellicola interna di vinilestere, per le colonne. Devono essere evitati elementi metallici nelle torri, pompe e soprattutto nel circuito acido. È consigliabile che le pompe siano di tipo a trascinamento magnetico e costruite in PP. La girante delle pompe tende a subire usura per abrasione. Nel caso del cristallizzatore si opta per un acciaio inossidabile ad alta resistenza alla corrosione come il 316L o il 904 L.
Quando l’impianto viene fermato, deve essere impedita la cristallizzazione di sali nel riempimento, nel serbatoio e nei circuiti del prodotto concentrato, per cui si raccomanda di mantenerlo in ricircolo.
Il riempimento delle torri (in particolare quello della torre di assorbimento) deve essere facilmente smontabile per una possibile pulizia.
Campi di applicazione del solfato di ammonio
1. Utilizzo in agricoltura
Il (NH4)2SO4 è un prodotto di applicazione diretta per uso agricolo; eccellente fertilizzante di «inizio» o di «fondo» al momento della semina. È il prodotto adatto per ogni tipo di terreno e coltura; a rilascio controllato (azione immediata ed effetto prolungato) con buone qualità di conservazione. Essendo un fertilizzante con azoto e zolfo in maggiore concentrazione, il calcio modifica leggermente il pH del suolo nella zona di applicazione, in modo che il calcio sia il meglio sfruttato dalla coltura. La sua fluidità e stabilità chimica sono eccellenti, facilitando la preparazione di formule fertilizzanti in miscele fisiche e la loro applicazione manuale o meccanica.
L’azoto e il fosforo influenzano la crescita e lo sviluppo del fogliame, delle radici e dei fusti delle piante, così come l’ottimale sviluppo dei microrganismi; lo zolfo fa parte degli amminoacidi solforati presenti nelle proteine.
Il calcio influisce sulla qualità del prodotto e sulla resistenza dei frutti o ai danni da parassiti. Il solfato di ammonio granulare non si perde per lisciviazione a causa dell’assorbimento dell’ammonio da parte dei colloidi del suolo e della sua degradazione controllata.
2. Utilizzo industriale
Il (NH4)2SO4 è un prodotto con alta domanda nel settore industriale. È presente in adesivi, plastiche, resine, inchiostri, prodotti farmaceutici e finiture per prodotti tessili, carta e metalli, industria della panificazione. Viene miscelato nell’alimentazione del bestiame. Viene anche usato nella produzione di cosmetici e vernici. Ed è anche utilizzato per la preparazione di prodotti farmaceutici.

Proprietà fisico-chimiche del solfato di ammonio
Proprietà fisiche
In stato puro sono cristalli bianchi a forma di rombi (piastre, agglomerati), ma nello stato commerciale come fertilizzante presentano una leggera tonalità gialla dovuta al solfuro di arsenico (proveniente da coke).
Densità: In stato puro è di 1,77, ma il solfato di ammonio agricolo presenta una densità apparente senza compattamento, da 0,8 a 1,1.
Solubilità: In acqua è molto elevata e aumenta considerevolmente con la temperatura. La solubilità in kg di solfato di ammonio per litro d’acqua è: a 0 ºC, 70,6; a 20 ºC, 77,4; a 60 ºC, 88,0 e a 100 ºC, 103,3.
Igroscopicità: propria del solfato di ammonio non è molto alta essendo l’umidità atmosferica critica del 70%, ma può aumentare se esiste acido solforico libero, la cui avidità d’acqua è molto elevata. Indice di igroscopicità a 30 ºC = 20.
Punto di fusione: 280 ºC
Pressione di vapore: 1,871 KPa a 20ºC
Reazione del fertilizzante: Acida. Indice di acidificazione = 110
Salinità: Indice di salinità = 69.
Proprietà chimiche
È il risultato dell’azione di un acido forte (solforico) su una base debole (ammoniaca). Questo spiega che le sue soluzioni siano parzialmente idrolizzate e abbiano una reazione leggermente acida. Per la stessa ragione, l’ebollizione fa liberare ammoniaca. Il solfato di ammonio può dare miscele esplosive con ossidanti forti, come i clorati.
A temperatura elevata si produce perdita di NH3. Si decompone facilmente a temperatura normale con prodotti alcalini, producendo liberazione di ammoniaca.
Prodotti commerciali
Il solfato di ammonio agricolo si presenta commercialmente in forma di:
Solfato di sintesi, con 21% di N
Solfato di recupero: dal 20,5 al 20,8% di N
Scheda tecnica del prodotto

Conclusioni
Anche se può sembrare ovvio, non esiste effluente meglio trattato né che danneggi meno l’ambiente di quello che non viene scaricato. Inoltre, in molte occasioni, determinati scarichi possono influire molto sull’effluente generale della fabbrica, anche se rappresentano un piccolo volume, poiché la loro concentrazione, tossicità o carica inquinante possono essere proporzionalmente elevate rispetto al resto degli effluenti da depurare. In questi casi conviene segregarli e trattarli separatamente o inviarli a un impianto di trattamento. In ogni caso, sarà opportuno ridurne il volume per minimizzare i costi di trasporto e persino arrivare a smaltirlo come residuo solido, cosa che si ottiene con mezzi meccanici (filtri a pressa, centrifughe, filtri a nastro, ecc.) o per evaporazione a basso consumo (evaporatori a vuoto, termocompressione, ecc.). Sebbene questi processi siano costosi, di solito si ammortizzano a medio termine, poiché l’impianto di depurazione generale della fabbrica potrà essere più semplice, e i suoi costi di installazione e gestione saranno minori e, cosa più importante: il rischio di inquinamento ambientale sarà minimizzato.
Quale soluzione migliore che riuscire a rivalorizzare questi effluenti? Questo riduce in modo molto importante il periodo di ammortamento dell’investimento e della gestione. Il caso presentato in questo articolo ne è un chiaro esempio.
Bibliografia
- Manuale dell’Ingegnere Chimico (volume I) 6ª edizione
- Elementi di Ingegneria Chimica (Vian Ocón)
- https://quimica.laguia2000.com/general/sulfato-de-amonio (settembre 2010)
- Biblioteca universitaria – Università di Oviedo.