
La fotocatalisi è una delle varianti dei processi di ossidazione avanzata (PAO), che sono particolarmente interessanti per il trattamento dell’acqua e dell’aria grazie alla loro efficienza nel neutralizzare una grande varietà di contaminanti mediante la generazione di radicali ossidrilici altamente reattivi. Tra i PAO, la fotocatalisi, principalmente quella che utilizza biossido di titanio (TiO2) come fotocatalizzatore, è stata ampiamente studiata negli ultimi anni. Questa nuova tecnologia è oggi considerata un concorrente delle tecniche di purificazione classiche. Per questo motivo, sempre più studi scientifici e brevetti si trovano in letteratura.
Sebbene inizialmente si utilizzassero fotocatalizzatori a base di TiO2 per il trattamento dell’acqua, negli ultimi anni si è osservato che l’ossidazione fotocatalitica di composti organici volatili (COV) è generalmente più efficiente in fase gassosa che in fase liquida.
Ultimamente, il numero di brevetti per il trattamento dell’aria supera quello di tutti i brevetti per il trattamento dell’acqua e delle superfici autopulenti. Ciò dimostra il reale interesse mostrato dalla comunità industriale nelle applicazioni di purificazione dell’aria.
Le origini della fotocatalisi
Il primo rapporto pubblicato sulla fotorreattività fu redatto da Renz nel 1921. Tuttavia, il primo titolo che faceva riferimento al termine “foto-catalisi” non fu pubblicato fino al 1964, in un articolo di Hauffe sul Journal of Catalysis. Secondo Teichner et al. [1], è interessante sottolineare che il concetto e il termine “fotocatalisi eterogenea” furono introdotti e sviluppati a Lione nel 1972, dove furono anche proposte possibili soluzioni fotocatalitiche a vari problemi ambientali utilizzando TiO2.
Inizialmente, P. Pichat e J. M. Herrmann ampliarono i primi studi sulla fotocatalisi eterogenea di Lione ad applicazioni ambientali e contro l’inquinamento presso l’Istituto di Ricerca sulla Catalisi (IRC). Nel 1999, la pubblicazione “Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants”, di J.M. Herrmann, vinse un premio come uno dei 10 articoli più citati quell’anno su Catalysis Today [2].
Fotocatalisi mediata da TiO2
Tra i semiconduttori disponibili che possono essere usati come fotocatalizzatori, il TiO2 è normalmente considerato il miglior fotocatalizzatore disponibile oggi. Una schiacciante maggioranza della letteratura relativa alla fotocatalisi si concentra sull’identificazione delle proprietà, applicazioni e teoria d’uso del biossido di titanio come semiconduttore. Ci sono buone ragioni per cui il TiO2 è il semiconduttore preferito, come ad esempio:
- Ha un grande potenziale di ossidazione a temperatura e pressione ambiente.
- Mostra una grande attività fotocatalitica per degradare un’ampia gamma di contaminanti ambientali.
- È chimicamente inerte.
- È fisicamente stabile.
- Non è tossico.
- È superidrofilico.
- È economico e facilmente accessibile.
Sono già disponibili sul mercato diversi prodotti commerciali di TiO2 fotocatalitico; in particolare il Degussa P25 TiO2, che sotto molti aspetti è considerato uno standard e viene spesso utilizzato come elemento di confronto nella sperimentazione scientifica per determinare l’attività fotocatalitica.
Cos’è un semiconduttore?
I materiali semiconduttori si caratterizzano per la loro struttura elettronica, che può essere descritta con la teoria delle bande dei materiali [3]. La teoria delle bande stabilisce che tutti i materiali hanno livelli elettronici possibili, definiti come bande. I materiali si classificano in base alla separazione energetica esistente tra queste bande, nota anche come banda proibita. La figura 1 illustra schematicamente le differenze nella struttura elettronica di un isolante (banda proibita molto ampia), un semiconduttore (banda proibita minore) e un metallo (senza banda proibita, con una continuità degli stati elettronici in tutto il materiale). Secondo la teoria delle bande, la banda di valenza corrisponderebbe ai livelli di energia occupati, mentre la banda di conduzione sarebbe costituita dagli stati elettronici disponibili e vacanti fino a quando il materiale non viene eccitato termicamente o elettronicamente.
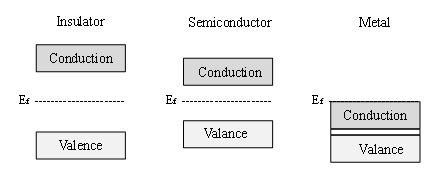 Figura 1. Diagramma schematico della struttura a bande di un isolante, un semiconduttore e un metallo.
Figura 1. Diagramma schematico della struttura a bande di un isolante, un semiconduttore e un metallo.
Fotoeccitazione del TiO2
Nella Figura 2 è illustrata la formazione di una coppia elettrone-lacuna nella fotocatalisi del TiO2. Gli elettroni di valenza responsabili del mantenimento degli atomi insieme occupano normalmente la banda di valenza. Gli elettroni responsabili delle proprietà elettroconduttive occupano la banda di conduzione. Tra le due bande si trova la banda proibita o gap energetico. Questa regione è non occupata, poiché gli elettroni non possono avere il valore energetico corrispondente al livello proibito. Un conduttore ha abbastanza elettroni per occupare anche la banda di conduzione, mentre in un isolante la banda di conduzione è essenzialmente vuota. Il biossido di titanio (TiO2) è un semiconduttore, il che significa che ha una banda proibita più stretta (3,2 eV per anatase e 3,0 eV per rutilo) rispetto agli isolanti. La banda di conduzione diventa accessibile agli elettroni della banda di valenza quando c’è energia sufficiente per l’eccitazione. Questa energia permette agli elettroni di “saltare” attraverso la banda proibita. Il processo di eccitazione dell’elettrone lascia dietro di sé una carica positiva o lacuna nella banda di valenza. La fotocatalisi mediata dal semiconduttore è innescata dalla capacità di questa coppia elettrone-lacuna di avviare una reazione catalitica.
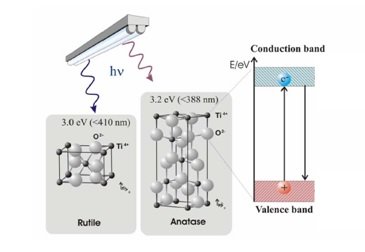 Figura 2. Formazione della coppia elettrone-lacuna nel TiO2 (rutilo – anatase).
Figura 2. Formazione della coppia elettrone-lacuna nel TiO2 (rutilo – anatase).
Meccanismo generale della reazione fotocatalitica
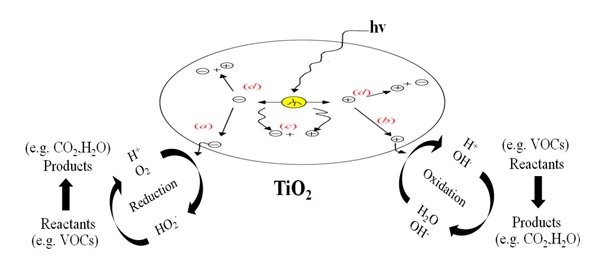 Figura 3. Processo generale della fotocatalisi del TiO2.
Figura 3. Processo generale della fotocatalisi del TiO2.
(a) L’elettrone della banda di conduzione che migra con successo alla superficie innesca la reazione di riduzione.
(b) La lacuna della banda di valenza che migra alla superficie innesca il processo ossidativo.
(c) La lacuna della banda e l’elettrone della banda di conduzione si ricombinano nel materiale grezzo.
(d) La lacuna della banda e l’elettrone della banda di conduzione si ricombinano sulla superficie.
Trattamento dell’aria mediante ossidazione fotocatalitica (OFC)
L’OFC nella purificazione dell’aria implica un gas carico di contaminanti e un fotocatalizzatore, normalmente in forme immobilizzate. Di seguito un riassunto dei vantaggi del trattamento fotocatalitico dell’aria:
- Facile generazione della fotocatalisi.
- Maggiore velocità di reazione rispetto alla fotocatalisi liquida.
- Capacità di ossidare basse concentrazioni e flussi di scarto a basso volume a temperature e pressioni ambientali o diverse.
- Le reazioni in fase gassosa permettono l’applicazione diretta degli strumenti analitici per monitorare la composizione, la struttura e lo stato elettronico del substrato e degli adsorbati; pertanto i meccanismi di reazione possono essere elucidati direttamente.
- I reattori fotocatalitici possono essere integrati in sistemi di riscaldamento, ventilazione o condizionamento dell’aria (HVAC), nuovi o preesistenti, grazie al loro design modulare, al funzionamento a temperatura ambiente e alla trascurabile caduta di pressione. Inoltre, possono essere scalati per adattarsi a una vasta gamma di applicazioni per la qualità dell’aria.
- Potenziale utilizzo di energia solare.
La tabella 1 riassume gli studi sulla fotocatalisi con TiO2 per il trattamento dell’aria con diversi gruppi di contaminanti organici. La tabella mostra che i diversi gruppi di sostanze chimiche mostrano un comportamento differente, unico per ciascun gruppo.
Tabella 1. OFC nella purificazione dell’aria
Parametri che influenzano il processo fotocatalitico
Un processo fotocatalitico tipico è molto complesso, con molti fattori che influenzano l’efficienza fotocatalitica. È possibile distinguere tra parametri intrinseci ed estrinseci. I parametri intrinseci sono quelli legati alle proprietà del fotocatalizzatore stesso (fisiche e chimiche). I parametri estrinseci sono fattori esterni, come le condizioni operative. Di seguito si discutono alcuni di questi parametri.
- Concentrazione in ingresso del contaminante.
- Temperatura.
- Fonti di luce (UV-Solare).
- Supporto e carica della catalisi.
Disattivazione e rigenerazione del fotocatalizzatore
La disattivazione del fotocatalizzatore si verifica quando si osserva una diminuzione graduale della velocità di conversione in esperimenti prolungati con condizioni invariabili. La perdita di attività fotocatalitica del catalizzatore può essere considerata reversibile o irreversibile. In generale, la disattivazione sarà irreversibile se vi è assorbimento chimico e reversibile quando l’assorbimento è fisico. La disattivazione può essere causata dall’assorbimento e accumulo di sottoprodotti fortemente legati sulla superficie, che bloccano i punti attivi del fotocatalizzatore.
Un fotocatalizzatore può essere rigenerato parzialmente o completamente purgando il sistema con uno o più dei seguenti elementi:
- Solo acqua.
- Aria pura sotto illuminazione.
- Aria umida con o senza illuminazione.
- Aria con H2O2, con o senza illuminazione.
- Aria con O3, con o senza illuminazione.
- Aria pura sotto illuminazione a temperatura elevata.
Conclusioni
Nonostante sia stato fatto un grande lavoro sulla fotocatalisi per il trattamento dell’aria, l’effetto ambientale dell’OFC non è ancora completamente compreso. In letteratura, generalmente, la performance fotocatalitica viene valutata in base alla conversione del contaminante target e all’influenza dei diversi parametri operativi. Ci sono poche informazioni sulla natura e il tipo di sottoprodotti prodotti e nessuna sulla mineralizzazione del CO2. Queste informazioni sono essenziali per comprendere il processo e per sviluppare con successo applicazioni fotocatalitiche commerciali. La Figura 4 mostra la conoscenza attuale nell’applicazione della tecnologia OFC per risolvere i problemi di inquinamento atmosferico.
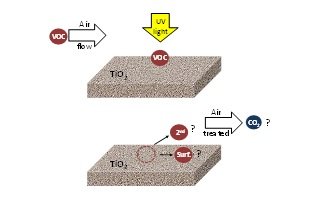 Figura 4. COV che agiscono sul TiO2 irradiato: formazione di contaminanti secondari (2nd) reimmessi nell’aria trattata, specie di ossidazione legate alla superficie (surf) e formazione di CO2.
Figura 4. COV che agiscono sul TiO2 irradiato: formazione di contaminanti secondari (2nd) reimmessi nell’aria trattata, specie di ossidazione legate alla superficie (surf) e formazione di CO2.
Bibliografia
[1] Teichner, S., The origins of photocatalysis. Journal of Porous Materials, 2008. 15(3): p. 311-314.
[2] Herrmann, J.-M., Heterogeneous photocatalysis: fundamentals and applications in the removal of various types of aqueous pollutants. Catalysis Today, 1999. 53(1): p. 115-129.
[3] Mills, A. and S. Le Hunte, An overview of semiconductor photocatalysis. Journal of Photochemistry and Photobiology A: Chemistry, 1997. 108(1): p. 1-35.