Cos’è la cristallizzazione?
La cristallizzazione è un metodo di separazione in cui si produce la formazione di un solido (cristallo o precipitato) a partire da una fase omogenea, liquida o gassosa. Il solido formato può arrivare ad essere molto puro, per cui la cristallizzazione viene impiegata a livello industriale come processo di purificazione. D’altra parte, la cristallizzazione di acque contenenti sali, o trattamento di salamoie, è un’applicazione molto comune nei processi industriali che generano acque reflue.

Perché la cristallizzazione possa avvenire è condizione indispensabile che la soluzione sia sovrasatura. I processi di cristallizzazione differiscono tra loro nel metodo con cui si ottiene la sovrasaturazione. In generale, si può ottenere in tre modi differenti:
- Sovrasaturazione prodotta dal raffreddamento della soluzione con evaporazione trascurabile.
- Sovrasaturazione prodotta dall’evaporazione del solvente con poco raffreddamento.
- Evaporazione per combinazione di raffreddamento ed evaporazione in evaporatori adiabatici (cristallizzatori a vuoto).
È importante tenere presente che per utilizzare i cristallizzatori in cui la sovrasaturazione si ottiene mediante raffreddamento, i soluti devono avere una curva di solubilità che diminuisce significativamente con la temperatura. Nei casi in cui la solubilità non dipende praticamente dalla temperatura, la sovrasaturazione si ottiene evaporando il solvente. E quando si utilizza la combinazione di raffreddamento ed evaporazione, una soluzione viene sottoposta a condizioni di vuoto affinché il solvente evapori improvvisamente e la soluzione si raffreddi adiabaticamente.
Quest’ultimo metodo è il più utilizzato a livello industriale per provocare la sovrasaturazione. In pratica, esiste un’ampia varietà di cristallizzatori industriali, ciascuno progettato specificamente per ottenere in modo ottimale la sovrasaturazione della soluzione, in funzione delle caratteristiche e proprietà di questa.
Come funziona il processo di cristallizzazione?
Il processo di cristallizzazione non è semplice e la fase più importante consiste nella formazione di cristalli solidi all’interno della soluzione liquida. La soluzione si concentra e si raffredda fino a quando la concentrazione del soluto è superiore alla solubilità a quella temperatura e il soluto forma cristalli quasi puri.
La velocità di crescita di un cristallo è nota come velocità di cristallizzazione. La crescita avviene prima con la formazione del nucleo e poi la sua crescita procede gradualmente. Quando la concentrazione è superiore alla sovrasaturazione, la nucleazione – formazione di nuclei – avviene in modo naturale, spontaneo e rapido. La velocità di cristallizzazione può essere espressa mediante la seguente equazione empirica:
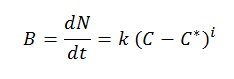
Dove:
- B: velocità di nucleazione (nuclei formati per unità di tempo e di volume di solvente)
- N: numero di nuclei formati per unità di volume di solvente
- t: tempo
- k, i: parametri empirici
- (C-C*): sovrasaturazione
- C: concentrazione del soluto nella soluzione
- C*: concentrazione di saturazione del soluto
Dall’equazione si deduce che la velocità di nucleazione è funzione diretta della sovrasaturazione. È stato verificato che quando la sovrasaturazione è elevata, la velocità di nucleazione – e anche la velocità di crescita del cristallo – sono anch’esse elevate, dando luogo a cristalli piccoli, imperfetti e con impurità. Al contrario, quando la sovrasaturazione è bassa, la velocità di formazione è piccola, la crescita dei cristalli è regolare e si ottengono cristalli di grande dimensione e di elevata purezza.

Nella cristallizzazione si distinguono principalmente due fasi: la nucleazione e la crescita dei cristalli. Entrambi i processi avvengono, se le condizioni sono favorevoli, nella zona sovrasatura del grafico. Tuttavia, per la nucleazione è richiesta una sovrasaturazione maggiore rispetto alla crescita. L’area di formazione nucleare dove si verifica la sovrasaturazione è chiamata zona instabile, mentre l’area di crescita è nota come zona metastabile. Per la nucleazione è necessario che la soluzione raggiunga la zona instabile. Tuttavia, una volta lì, i nuclei cresceranno troppo rapidamente e i cristalli risultanti saranno molti e molto piccoli. Per ottenere la formazione di cristalli il più grandi e puri possibile, è necessario controllare la quantità di nuclei in formazione. Se la soluzione non contiene impurità né cristalli del proprio tipo, il nucleo può essere formato solo da nucleazione omogenea. Se sono presenti alcune particelle estranee, la nucleazione si facilita e il processo è noto come nucleazione eterogenea. Entrambe le nucleazioni, omogenea ed eterogenea, avvengono in assenza di cristalli della stessa soluzione e sono collettivamente conosciute come nucleazione primaria. La nucleazione secondaria si riferisce al processo di formazione di cristalli che è condizionato e prodotto dalla presenza di particelle della stessa fase nel sistema sovrasaturo.
Applicazioni della cristallizzazione
Il processo di cristallizzazione ha numerose applicazioni industriali e non sempre si persegue l’ottenimento di cristalli puri. I cristallizzatori sono spesso utilizzati come parte di un trattamento più ampio di effluenti liquidi. In questo caso, l’obiettivo principale è la separazione dell’inquinamento presente in un effluente dal solvente stesso, in modo da ottenere il solvente puro e l’inquinamento in forma solida, per facilitarne la gestione in modo economico. Per esempio, questa applicazione della cristallizzazione è indispensabile nei processi di scarico zero, in cui l’effluente viene separato in due correnti, quella del solvente relativamente puro e adatto al riutilizzo, e quella dell’inquinamento in stato solido o semi-solido.
Pertanto, la cristallizzazione si presenta anche come un’ottima soluzione nei casi in cui l’obiettivo principale non è l’ottenimento di un prodotto solido di elevata purezza, come avviene nelle seguenti applicazioni:
- Trattamento di effluenti con un’elevata carica inquinante
- Trattamento di effluenti quando le tecniche convenzionali non sono efficaci (come nel caso delle salamoie)
- Impossibilità di poter scaricare gli effluenti trattati
- Trattamento di effluenti la cui composizione fluttua ed è molto variabile
Attualmente, è possibile disporre di cristallizzatori per il trattamento di acque con sali che sono molto competitivi in termini di efficienza energetica, basandosi su un’evaporazione a vuoto tramite pompa di calore, e molto robusti nel loro funzionamento.