Abschnitte
- Grundlegende Eigenschaften von Lithium
- Anwendungen von Lithium
- Recycling von elektronischen Geräten mit Lithium-Ionen-Batterien
- Gewinnung und Raffinierung von Lithium
- Recycling von Batterien und Rückgewinnung von Lithium
- Fazit
Grundlegende Eigenschaften von Lithium
Lithium (Li) ist das leichteste Metall mit einer Dichte, die halb so groß ist wie die von Wasser. Wie die anderen Alkalimetalle ist es einwertig und hochreaktiv, allerdings weniger als Natrium, weshalb es in der Natur nicht in freier Form vorkommt.
Es ist ein mäßig häufiges Element; in der Erdkruste mit 65 ppm vorhanden, liegt es unter Ni, Cu und W und über Cr und Sn.
Zusammen mit H und He ist Li eines der wenigen Elemente, die während des Urknalls gebildet wurden. Alle anderen wurden durch Kernfusion in Hauptreihensternen oder bei Supernova-Explosionen synthetisiert.
Seine grundlegenden physikalisch-chemischen Eigenschaften sind:
- Dichte: 535 kg/m³
- Mohshärte: 0,6
- Aussehen: silbrig-weiß, grauer Feststoff
- Atommasse: 6,941
- Atomradius: 167 pm
- Oxidationszustand: starke Base
- Kristallstruktur: kubisch raumzentriert
- Schmelzpunkt: 453,69 K
- Siedepunkt: 1615 K
- Spezifische Wärme: 3582 J/(kg·K)
Eigenschaftlich ist Lithium ein weiches, silbrig-weißes Metall mit einer sehr niedrigen Mohshärte von 0,6. Seine Atommasse beträgt ca. 6,94 u, und der Atomradius liegt bei 167 pm. Die Kristallstruktur von Lithium ist kubisch raumzentriert. Es hat einen Schmelzpunkt von 453,7 K und einen Siedepunkt von 1615 K.
Bemerkenswert ist, dass Lithium eine extrem hohe spezifische Wärmekapazität (3582 J/(kg·K)) besitzt, die höchste aller festen Elemente. Außerdem zeigt es ein hohes elektrochemisches Potential (das negativste Standard-Reduktionspotential unter den Metallen). Diese Eigenschaften sind die Grundlage für den Wert von Lithium in Energiespeicher- und Wärmetransferanwendungen.
Anwendungen von Lithium
Lithium wird oft als „weißes Öl“ oder „weißes Gold“ bezeichnet, aufgrund der zentralen Rolle, die es derzeit und auch zukünftig in der globalen Energielandschaft spielt.
Lithium-Ionen-Batterien sind bei weitem der größte Verbraucher von Lithium weltweit und übertreffen alle anderen Anwendungen zusammen.
Seine Eigenschaften machen Lithium-Ionen zum idealen Bestandteil für die Batteriefertigung. Dank seiner hohen spezifischen Wärme wird Lithium in Wärmetransferanwendungen eingesetzt, und aufgrund seines hohen elektrochemischen Potentials dient es als geeignetes Anodenmaterial für Batterien in Elektrofahrzeugen, Smartphones und verschiedenen elektronischen Geräten. Li-Ionen-Batterien sind sehr energiedicht, was längere Laufzeiten und Reichweiten in Geräten und E-Fahrzeugen ermöglicht.

Lithium hat auch mehrere andere Anwendungen, obwohl deren Verbrauch im Vergleich zur Batterienutzung relativ gering ist:
- Pharmazeutika: Lithiumsalze, insbesondere Lithiumcarbonat (Li₂CO₃) und Lithiumcitrat, werden zur Behandlung von Manie und bipolaren Störungen sowie neuerdings bei unipolaren Depressionen eingesetzt. Sie wirken als Stimmungsstabilisatoren, was vermutlich mit ihren Effekten auf die Serotoninfunktion zusammenhängt. Lithium ist im Blutplasma und/oder in roten Blutkörperchen gelöst vorhanden.
- Trocknungsmittel: Lithiumchlorid und Lithiumbromid sind stark hygroskopisch und daher ausgezeichnete Trockenmittel. Lithiumbromid wird insbesondere in Absorptionswärmepumpen verwendet, zusammen mit anderen Verbindungen wie Lithiumnitrat.
- Schmierstoffe: Lithiumstearat wird weit verbreitet als Hochtemperaturschmiermittel eingesetzt.
- Chemische Synthese: Lithium dient als Reagenz bei der Synthese organischer Verbindungen.
- Luftreinigung: Lithiumhydroxid wird in Raumfahrzeugen und U-Booten verwendet, um Kohlendioxid aus der Luft zu entfernen.
- Legierungen und Materialien: Lithium ist ein häufiger Bestandteil von Aluminium-, Cadmium-, Kupfer- und Manganlegierungen, die im Luft- und Raumfahrtbau verwendet werden. Es wurde auch erfolgreich bei der Herstellung von Keramiken und optischen Linsen eingesetzt, wie z. B. beim 5,08 m großen Teleskop am Mount Palomar.
- Kerntechnische Anwendungen: Lithium besitzt zwei stabile Isotope, Li-6 und Li-7, wobei letzteres mit 92,5 % das häufigste ist.
Recycling von elektronischen Geräten mit Lithium-Ionen-Batterien
Die Verarbeitung und das Recycling von Abfällen aus elektrischen und elektronischen Geräten wie Computern, Autobatterien, E-Bike- und Scooter-Batterien, Tablets, Kopfhörern oder Mobiltelefonen sind aufgrund des raschen Anstiegs des Verbrauchs dieser Produkte wichtiger denn je.
Die derzeitigen industriellen Recyclingbemühungen konzentrieren sich meist auf die wertvolleren Metalle in der Batterie (wie Kobalt und Nickel), während Lithium selbst oft übersehen oder verworfen wird. Dies mag kontraintuitiv erscheinen, war aber historisch eine wirtschaftliche Realität: Der Marktpreis von Lithium war im Vergleich zu Kobalt oder Nickel niedrig, sodass es weniger finanziellen Anreiz gab, es zurückzugewinnen. Zudem können Lithium-Rückgewinnungsprozesse technisch anspruchsvoll und kostspielig sein, was das Lithium-Recycling unter früheren Marktbedingungen teuer und oft unrentabel machte.
Heutzutage werden bei der Rückführung von Lithium-Ionen-Batterien typischerweise zuerst die wertvollen Metalle wie Kobalt, Nickel und Kupfer extrahiert. Beispielsweise kann Kobalt aus Li-Ionen-Batterien als Lithium-Kobaltoxid oder andere Verbindungen zurückgewonnen werden, aufgrund des hohen Marktpreises und der kritischen Versorgungslage von Kobalt. Lithium hingegen landete in schmelzbasierenden Recyclingprozessen oft in der Schlacke oder im Abfallstrom. Dies stellt eine verpasste Chance dar, da Lithium eine endliche Ressource ist und die Nachfrage stark steigt.
Die Rückgewinnung von Lithium aus Altbatterien kann den Bedarf an neuem Lithiumabbau erheblich reduzieren und die Versorgung dieses kritischen Materials stärken. Zudem verringert sie die Umweltbelastung durch Wiederverwendung bereits extrahierten Lithiums.
Dennoch beschleunigen der rasante Anstieg der Elektromobilität und der globale Übergang zu sauberer Energie Innovationen bei Batterierecycling-Technologien. Regierungen erlassen zudem Vorschriften und setzen Ziele, die Recycling und Ressourcenkreisläufe fördern. In den folgenden Abschnitten werden wir die globale Landschaft des Lithiumbatterie-Recyclings und die sich entwickelnden Technologien zur wirtschaftlichen Lithiumrückgewinnung untersuchen.
Globale Recycling-Landschaft
Aktuelle Studien liefern widersprüchliche Zahlen.
Eine Studie aus dem Jahr 2023 schätzte, dass weltweit etwa 59 % der Alt-Lithium-Ionen-Batterien recycelt werden. Prognosen basierend auf Angebots-Nachfrage-Modellen deuten jedoch darauf hin, dass bis 2050 weniger als 20 % des Lithiumangebots aus Recycling stammen werden. Diese Diskrepanz verdeutlicht die anhaltenden Herausforderungen bei der genauen Messung und Skalierung der Lithiumrückgewinnung weltweit.
Regional gibt es große Unterschiede:
- Im Jahr 2023 wurde die weltweite Recyclingkapazität für Lithiumbatterien auf über 300 GWh pro Jahr geschätzt.
- China ist mit über 80 % der globalen Kapazität führend im LIB-Recycling.
- Europa und die USA verfügen jeweils über weniger als 2 % der globalen Recyclingkapazität, investieren jedoch stark, um aufzuholen.
- Ambitionierte Ziele in der Europäischen Union zielen darauf ab, die Batteriesammlung und Materialrückgewinnung drastisch zu erhöhen, wobei Prognosen nahelegen, dass bis Mitte des Jahrhunderts recyceltes Lithium bis zu 50 % des europäischen Lithiumbedarfs decken könnte.
Der globale Markt für Lithium-Ionen-Batterie-Recycling wächst rasant parallel zum Boom der Batterienutzung. Im Jahr 2024 wurde der LIB-Recyclingmarkt auf etwa 10,3 Milliarden USD geschätzt und soll bis 2034 auf 98,4 Milliarden USD anwachsen, mit einer beeindruckenden jährlichen Wachstumsrate (CAGR) von ca. 25,4 % über das Jahrzehnt.
Zum Vergleich: Der Gesamtmarkt für Batterierecycling (alle Batterietypen) wird von etwa 22,8 Milliarden USD im Jahr 2024 auf 41,7 Milliarden USD im Jahr 2030 wachsen. Diese Zahlen spiegeln das enorme Volumen an Batterien wider, die ausgemustert werden, sowie den steigenden Wert der darin enthaltenen Materialien. Der Druck auf die Verfügbarkeit von Ressourcen, insbesondere kritischer Metalle wie Lithium, Nickel und Kobalt, macht Recycling zu einer strategischen Industrie an sich.
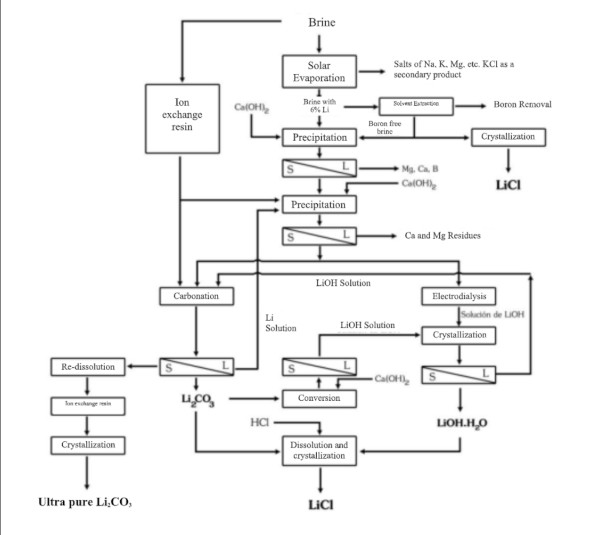
Gewinnung und Raffinierung von Lithium
Hartgesteinsabbau
Australien, der weltweit größte Lithiumproduzent, gewinnt Lithium aus Mineralerzen wie Spodumen (LiAlSi₂O₆). Der Spodumenabbau umfasst die traditionelle Gewinnung von Pegmatit-Erz, gefolgt von Zerkleinerung, Erhitzung und chemischer Behandlung zur Herstellung von Lithiumkonzentraten.

Obwohl effektiv, ist dieser Prozess energieintensiv, kostenintensiv und umweltbelastend. Hartgesteinsabbau und -verarbeitung haben typischerweise höhere Betriebskosten (geschätzt etwa 4.200–4.500 USD pro Tonne Lithiumcarbonat-Äquivalent) im Vergleich zur Solegewinnung.
Solegewinnung
In südamerikanischen Ländern wie Chile, Bolivien und Argentinien sowie in China wird Lithium oft aus riesigen Salzpfannen-Solen gewonnen.
Ein großer Anteil der weltweiten Lithiumproduktion stammt aus diesen Solen, deren Produktionskosten deutlich niedriger sind als die von Mineralvorkommen (laut John McNulty: 1.500–2.300 USD/Tonne vs. 4.200–4.500 USD/Tonne).

Die Lithium-Solextraktion erfolgt durch Pumpen, und die Konzentration kann entweder durch Adsorption mit einem selektiven Adsorbens oder durch Verdunstung in flachen Becken erreicht werden, die zu diesem Zweck angelegt sind.
1. Die Verdunstung erhöht nicht nur die Salzkonzentration, sondern bewirkt auch, dass bestimmte Salze bei Erreichen der Sättigung ausfallen. Über 12–18 Monate Verdunstung steigt die Lithiumkonzentration in der Sole von einem sehr niedrigen Wert (~0,1 % Li) auf einige Prozent, wobei Salze nacheinander ausfallen (NaCl, KCl usw.). Das Endkonzentrat wird weiterverarbeitet, um Lithiumcarbonat oder Lithiumchlorid zu gewinnen.
Die Vorteile der natürlichen Verdunstung sind:
- Sie verbraucht keine Energie
- Deutlich günstiger als Bergbau
- Erfordert wenige chemische Reagenzien
Nachteile sind:
- Notwendigkeit einer zusätzlichen Trennmethode
- Anfall von Abfällen
- Enormer Wasserverbrauch in ohnehin trockenen Regionen
- Starke Abhängigkeit von lokalen Wetterbedingungen (Verdunstungsrate und Niederschlag)
2. Die Adsorption bietet den Vorteil, dass sie von der Zusammensetzung der Sole unbeeinflusst ist (sie kann sogar bei lithiumarmen Solen angewandt werden, wie experimentell mit Meerwasser gezeigt wurde) und unabhängig von lokalen Wetterbedingungen funktioniert. Zudem fällt nur begrenzt Abfall an. Nachteile sind der Bedarf an chemischen Reagenzien, die hohen Kosten und Komplexität der Adsorptionsanlagen sowie die hohen Kosten des Adsorbens selbst.
Die größte weltweite Lithiumproduktion aus Solen stammt aus dem Salar de Atacama in Chile, wo die Verdunstungsmethode angewandt wird. Umfangreiche Betriebsdaten sind für diesen Prozess verfügbar, was einen Vergleich mit dem Salar de Uyuni in Bolivien ermöglicht.
- Die Atacama-Solen sind reicher an Lithium (sowie Kalium und Bor) als die von Uyuni. Folglich ist das Magnesium-zu-Lithium-Verhältnis (Mg/Li), das die Lithiumkonzentration beeinträchtigt, in Atacama 6:1 und in Uyuni 19:1.
- Die Lithiumreserven und -ressourcen Boliviens befinden sich in Solen mit einer ungefähren Dichte von 1.200 Gramm pro Liter (g/L). Eine Lithiumkonzentration von 0,1 Gew.-% entspricht somit 1.000 ppm oder 1,2 g/L.
- Während die Verdunstungs- und Niederschlagsraten in Atacama 3.200 mm/Jahr bzw. 10–15 mm/Jahr betragen, sind sie in Uyuni 1.500 mm/Jahr bzw. 200–500 mm/Jahr. Das heißt, Uyuni hat eine geringere Verdunstung und deutlich höheren Niederschlag, was den Verdunstungsprozess erheblich verlangsamt.
- In Atacama dauert der Verdunstungsprozess, der Lithium von 0,15 % auf 6 % konzentriert (eine 40-fache Steigerung), 12 bis 18 Monate; es wird erwartet, dass dieser Prozess in Uyuni deutlich länger dauert.
Eine Laborstudie mit dem Titel „Chemical Treatment of Brines from the Salar de Uyuni-Potosí“, durchgeführt 1987 in Frankreich im Rahmen des UMSA-ORSTOM-Abkommens (Französisches Institut für wissenschaftliche Entwicklungsforschung), simulierte die Bedingungen von Verdunstungsbecken in fünf Behältern. Die Studie stellte fest, dass Natriumchlorid (NaCl) zuerst ausfällt, gefolgt von Kaliumchlorid (KCl).
Da Magnesiumchlorid (MgCl₂) nicht durch Verdunstung getrennt werden kann, muss es durch Zugabe von Kalk als Magnesiumhydroxid (Mg(OH)₂) ausgefällt werden.
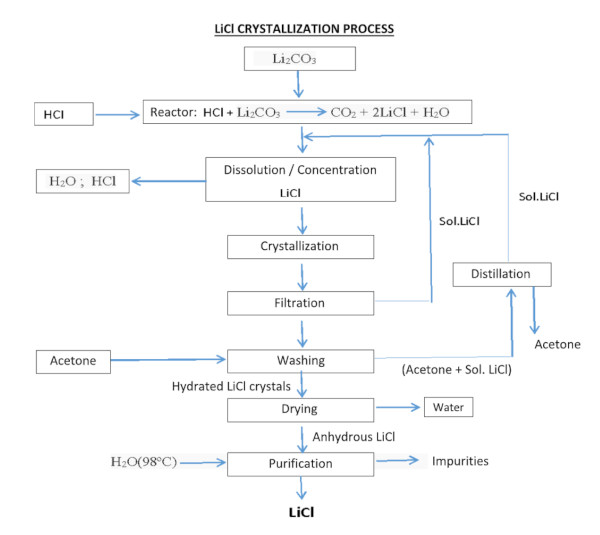
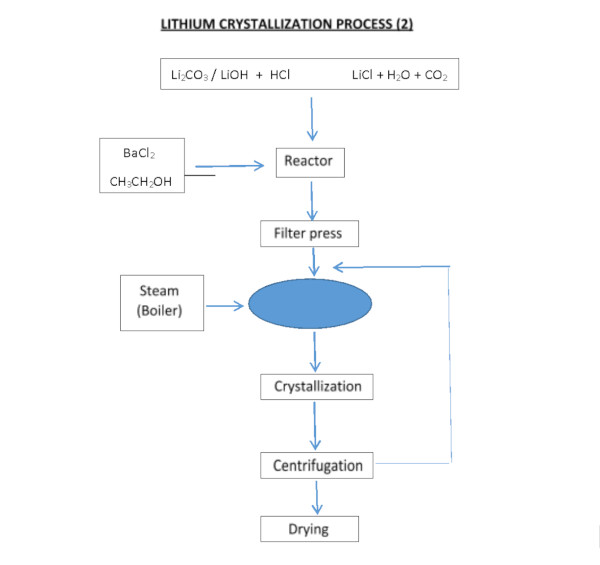
Der Prozess zur Gewinnung von Lithiumchlorid aus Carbonat oder Lithiumhydroxid kann durch Reaktion mit Salzsäure erfolgen:
Li2CO3 + 2HCl === 2LiCl + H2O + CO2
LiOH·H2O + HCl === LiCl + 2H2O
Bedeutung der Ausfällung und Raffinierung von Lithiumcarbonat
Das auf irgendeine Weise gewonnene Lithiumchlorid (LiCl) muss gereinigt, getrocknet und kristallisiert werden. Trotz des hohen Lithiumgehalts im Salar de Atacama und der umfangreichen Erfahrung bei der Gewinnung wurden Rückgewinnungsraten von nur 42 % berichtet.
Für die Verwendung in der Herstellung von Batterien für Elektrofahrzeuge muss Lithiumchlorid eine Mindestreinheit von 99,95 % erreichen. Daher erfordert das durch Ausfällung gewonnene LiCl eine weitere Raffinierung durch mehrere Reaktions- und Rekristallisationsstufen und in manchen Fällen durch Ionenaustauscherharze.
Da der Raffinierungsprozess kostspielig ist und die Rückgewinnung nach jeder Stufe abnimmt (geschätzt etwa 70 % während der Raffinierung), steigt der Preis von LiCl mit zunehmender Reinheit überproportional.
Zusammenfassend erfordert die primäre Lithiumgewinnung erheblichen Flächenverbrauch, Wasserverbrauch und Energieeinsatz und führt oft zu beträchtlichen Abfällen oder Umweltbelastungen.
Die Rückgewinnung von Lithium durch Recycling kann diese Auswirkungen drastisch reduzieren. Tatsächlich vermeidet das Recycling von Lithium-Ionen-Batterien neue Flächeninanspruchnahme und kann die Treibhausgasemissionen im Vergleich zur Herstellung von Lithiumchemikalien aus Primärrohstoffen um 17–61 % senken. Zudem wird typischerweise deutlich weniger Wasser verbraucht als bei der Lithiumgewinnung aus Solen.
Aus Umwelt- und Wirtschaftsperspektive besteht ein starker Anreiz, Lithium aus Batterien zu recyceln, als Ergänzung oder Alternative zum Bergbau, insbesondere da die globale Nachfrage weiter steigt.
Ausfällung und Raffinierung von Lithiumcarbonat
Ob aus Sole oder Hartgestein gewonnen, ist ein häufiges Endprodukt der Lithiumgewinnung Lithiumcarbonat (Li₂CO₃), das weit verbreitet in der Herstellung von Batteriekathoden (und anderen Anwendungen) verwendet wird. Die Umwandlung von Lithiumchlorid oder anderen Zwischenprodukten in Lithiumcarbonat erfolgt durch Ausfällungsreaktionen. Zum Beispiel führt die Zugabe von Natriumcarbonat (Soda) zu einer Lithiumchloridlösung zur Ausfällung von Lithiumcarbonat:
2 LiCl (aq) + Na₂CO₃ (aq) → 2 NaCl (aq) + Li₂CO₃ (s)↓
Das rohe Lithiumcarbonat wird anschließend filtriert, gewaschen und bei Bedarf auf Batteriestandard veredelt. Alternativ kann Lithiumchlorid durch Reaktion mit Kalk (Calciumhydroxid) zu Lithiumhydroxid (LiOH) umgewandelt werden, was oft bei bestimmten Batterietypen gewünscht ist.

Ein wichtiger Punkt ist, dass die Erreichung der ultrahohen Reinheitsgrade für batterietaugliches Lithiumcarbonat/-hydroxid eine Herausforderung darstellt. Selbst die lithiumreichste Sole der Welt (Atacama, Chile) erzielt nur etwa 42 % Rückgewinnung des Lithiums im ersten Verdunstungsschritt, und weitere Raffinierung führt zu Verlusten. Wie erwähnt, kann jede Reinigungsstufe (Rekristallisation, Ionenaustausch usw.) die Gesamtausbeute auf etwa 70 % des Inputs reduzieren. Daher kann beim Erreichen eines Endprodukts mit 99,9 % Li₂CO₃ ein großer Teil des ursprünglichen Lithiums in Mutterlaugen oder Abfallströmen verbleiben. Diese Ineffizienzen bei der Primärgewinnung unterstreichen, warum das Schließen des Kreislaufs durch Recycling attraktiv ist – sobald Lithium in einer Batterie ist, kann es durch Wiederverwendung und Recycling viel nachhaltiger im Kreislauf gehalten werden.
Es sei darauf hingewiesen, dass das Lithiumcarbonat-Äquivalent (LCE) die Standardmaßeinheit in der Lithiumindustrie ist; 1 Gramm Lithium entspricht 5,32 Gramm Li₂CO₃. Batteriehersteller verlangen zunehmend Lithium in Form von hochreinem Lithiumhydroxid (für Kathoden mit hohem Nickelanteil) oder Lithiumcarbonat (für LFP und andere Kathoden), was den Druck auf die Lieferkette erhöht, sehr reine Chemikalien entweder aus Minen oder Recyclinganlagen bereitzustellen.
Recycling von Batterien und Rückgewinnung von Lithium
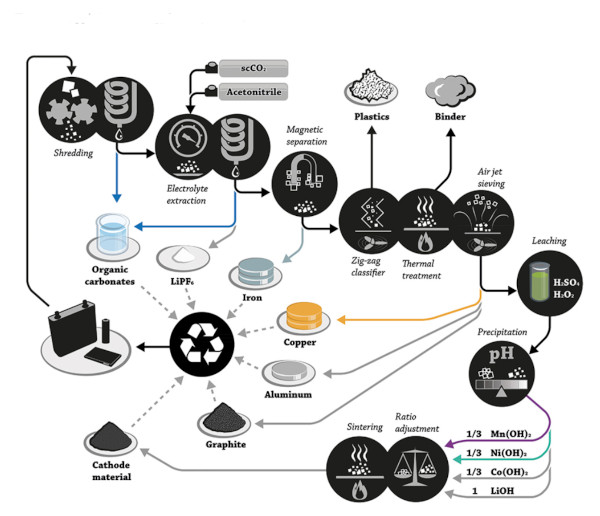
Im Bewusstsein der Notwendigkeit, die Lithiumrückgewinnung aus gebrauchten Batterien zu verbessern – insbesondere angesichts von Befürchtungen über zukünftige Knappheit und Preissteigerungen – entwickeln und pilotieren Forscher und Unternehmen weltweit verschiedene Recyclingverfahren für Lithiumbatterien. Im Allgemeinen umfassen Recyclingprozesse eine Kombination aus physikalischen und chemischen Schritten zur Isolierung und Rückgewinnung wertvoller Komponenten. Eine typische Recycling-Pipeline durchläuft folgende Phasen:
- Sammlung – Gebrauchte Batterien werden von Verbrauchern, Herstellern (Schrott) oder anderen Quellen eingesammelt.
- Vorbehandlung & Entladung – Batterien werden nach Typ/Chemie sortiert und vollständig entladen, um Restladung zu eliminieren (Sicherheit).
- Demontage/Zerkleinerung – Packs/Module werden demontiert. Zellen können kontrolliert zerkleinert oder geschreddert werden. Dies ergibt Materialgemische.
- Physikalische Trennung – Mechanische und physikalische Techniken (Siebung, Magnetabscheidung, Dichtetrennung usw.) trennen Komponenten: Stahlgehäuse, Aluminium- und Kupferfolien, Kunststoffe usw. Ziel ist es, die Schwarzmasse – ein Pulver mit Kathoden- und Anodenaktiven Materialien – zu konzentrieren, indem andere Materialien entfernt werden.
- Thermische/chemische Dekontamination – Verfahren wie Niedertemperatur-Thermobehandlung oder Lösungsmittel können verwendet werden, um Elektrolyte, Bindemittel und andere organische Stoffe zu entfernen, was Gefahren reduziert und die Schwarzmasse für die metallurgische Rückgewinnung vorbereitet.
- Metallurgische Rückgewinnung – Schließlich werden die kritischen Metalle (Li, Co, Ni, Mn usw.) in der Schwarzmasse durch geeignete chemische Verfahren extrahiert und gereinigt. Dies kann Hochtemperaturschmelzen (Pyrometallurgie), chemisches Auslaugen (Hydrometallurgie) oder andere neuartige Techniken umfassen. Das Ergebnis sind elementare Metalle oder häufiger chemische Verbindungen (Oxide, Sulfate, Carbonate usw.), die für die Wiederverwendung in der Batteriefertigung bereitstehen.
Jeder dieser Schritte kann je nach Prozess und Batterietyp unterschiedlich ausgeführt werden. Es gibt keine Einheitslösung: Das Recycling einer Laptop-Batterie mit Lithium-Kobaltoxid (LCO)-Kathode kann sich vom Recycling einer EV-Batterie mit Nickel-Mangan-Kobalt (NMC)-Kathoden oder einer LFP (Lithium-Eisenphosphat)-Batterie unterscheiden. Effektives Recycling erfordert oft eine Anpassung des Prozesses an die Batterietypologie und Bauform.
Physikalisch-chemischer Prozess (Pyrometallurgie vs. Hydrometallurgie)
Pyrometallurgisches Verfahren
Historisch war das pyrometallurgische Verfahren der häufigste Weg zum Recycling von Lithium-Ionen-Batterien.
Bei einem pyrometallurgischen Prozess werden Batterien (oft nach Vorbehandlung wie Trocknung oder Demontage) bei hohen Temperaturen (800–1400 °C) in einem Ofen eingeschmolzen. Organische Materialien und Kunststoffe verbrennen, und die Metalle schmelzen. Wertvolle Übergangsmetalle wie Kobalt, Nickel und Kupfer werden in einer Legierung (Metallschmelze) gesammelt, während Lithium (zusammen mit Aluminium, Mangan und anderen leichten Elementen) in die Schlacke (Oxidschmelze) übergeht.
Die Schlacke aus solchen Schmelzöfen wird manchmal in der Zement-/Bauindustrie verwendet oder kann weiterverarbeitet werden, um Lithium zurückzugewinnen, was jedoch oft nicht kosteneffektiv ist. Im Wesentlichen gewinnt die traditionelle Pyrometallurgie Lithium nicht direkt zurück, das in einer Schlacke endet, die für eine spätere Behandlung gelagert oder entsorgt wird.
Die Vorteile des pyrometallurgischen Recyclings sind:
- Relative Einfachheit und Robustheit.
- Es kann gemischten Batterieschrott ohne umfangreiche Sortierung oder Vorbehandlung verarbeiten.
- Es liefert Legierungsprodukte, aus denen Metalle wie Nickel und Kobalt später raffiniert werden können.
Die Nachteile sind erheblich:
- Der Prozess verbraucht viel Energie (Aufrechterhaltung von >1000 °C).
- Erfordert Abgasbehandlung für toxische Dämpfe.
- Hat eine geringe Gesamtrückgewinnungseffizienz für Lithium und andere leichte Elemente.
Die Lithiumrückgewinnung aus pyrometallurgischer Schlacke ist möglich, erfordert jedoch zusätzliche chemische Behandlung mit hohem Energie- oder Reagenzienaufwand, was wirtschaftlich oft unattraktiv ist. Kurz gesagt, Pyrometallurgie priorisiert die Rückgewinnung von Kobalt, Nickel und Kupfer; es ist ein etabliertes, aber unflexibles Verfahren mit begrenzter Fähigkeit, Lithium oder Graphit in nützlicher Form zurückzugewinnen.
Hydrometallurgisches Verfahren
In den letzten Jahren hat sich der Fokus auf hydrometallurgische Verfahren zum Batterierecycling verlagert.
Ein hydrometallurgisches Verfahren umfasst typischerweise das Auslaugen der zerkleinerten oder vorgetrennten Batteriematerialien in chemischen Lösungen, um Metallionen zu lösen. Säuren (wie Schwefel-, Salpeter- oder organische Säuren) dienen oft als Auslaugungsmittel, manchmal mit Reduktionsmitteln zur Unterstützung der Metallauflösung.
Beispielsweise kann Schwarzmasse mit Schwefelsäure in Gegenwart von Wasserstoffperoxid als Reduktionsmittel ausgelaugt werden, wodurch Li⁺, Co²⁺, Ni²⁺ usw. in Lösung gehen. Das Auslaugungslösung wird dann durch Trenn- und Reinigungsverfahren wie Lösungsmittel-Extraktion, selektive Ausfällung oder Ionenaustausch behandelt, um jedes Metall in verkaufsfähiger Form zurückzugewinnen.
Hydrometallurgie bietet folgende Vorteile:
- Sie arbeitet bei deutlich niedrigeren Temperaturen (oft unter 100 °C).
- Sie kann selektiver in der Rückgewinnung sein.
- Sie erreicht oft höhere Gesamtausbeuten. Moderne hydrometallurgische Verfahren können nahezu 100 % Lithium und Kobalt, etwa 98 % Mangan und hohe Nickelanteile aus Batterien zurückgewinnen.
- Das Ergebnis sind hochreine Verbindungen wie Lithiumcarbonat, Kobaltsulfat, Nickelsulfat usw., die direkt in der Batteriefertigung wiederverwendet werden können.
Der Nachteil ist:
- Hydrometallurgische Prozesse umfassen oft mehrere Stufen und den Einsatz chemischer Reagenzien, was flüssige Abfälle erzeugt, die behandelt werden müssen.
- Sie können komplexer im Betrieb und empfindlich gegenüber der Zusammensetzung des Inputs sein, was eine gute Sortierung und Vorbehandlung erfordert.
Trotz dieser Herausforderungen gilt Hydrometallurgie als nachhaltiger und effizienter als Pyrometallurgie für das LIB-Recycling, da sie höhere Rückgewinnungsraten und geringeren Energieverbrauch ermöglicht. Viele neue Recycling-Startups und Forschungsprojekte verfolgen hydrometallurgische oder hybride Hydro-/Pyro-Techniken, um die Materialrückgewinnung zu maximieren.
In der Praxis werden auch kombinierte Ansätze verwendet, z. B. eine Niedertemperatur-Thermobehandlung (zur Entfernung organischer Stoffe und Versprödung der Materialien) gefolgt von hydrometallurgischem Auslaugen.
Es gibt auch biometallurgische Methoden (Bioauslaugung mit Mikroben zur Säureerzeugung) in Entwicklung, die geringeren Chemikalieneinsatz versprechen, aber langsamer sein können.
Beispiel für ein hydrometallurgisches Verfahren
Ein beispielhafter Prozess für das Lithiumbatterie-Recycling umfasst ammoniakhaltiges Auslaugen zur Entfernung störender Metalle, gefolgt von Säureauslaugen der aktiven Materialien.
- Manuelle Demontage der Batterie und Zerkleinerung der Zellen zu feinem Pulver (~500–800 µm)
- Das Pulver wird zunächst mit Ammoniumhydroxid ausgelaugt, um selektiv Aluminium und Kupfer (von Stromabnehmern) zu lösen und zu entfernen. Die Entfernung dieser Basismetalle verhindert, dass sie Reagenzien verbrauchen oder spätere Schritte kontaminieren.
- Der verbleibende Feststoff (mit Kathoden- und Anodenmaterialien) wird dann mit starker Säure (z. B. Schwefelsäure) ausgelaugt. Dadurch gehen Lithium, Kobalt, Mangan und Nickel in Lösung.
- Die Rückgewinnungseffizienz im Auslaugungslösung wird mit 96,0–99,9 % für Li, Co, Mn, Ni angegeben.
- Nachfolgende Schritte neutralisieren die Lösung und fällen einzelne Elemente aus: z. B. führt Zugabe von Natriumhydroxid und Natriumbicarbonat zur Ausfällung von Mangan als MnCO₃, Kobalt als Co(OH)₂ und Lithium als LiHCO₃ (das zu Li₂CO₃ kalziniert werden kann).
- Abschließende Verdampfung und Kristallisation liefern gereinigte Verbindungen mit Metallrückgewinnungen über 96 %. Dieser Prozess zeigt, dass nahezu quantitative Lithiumrückgewinnung technisch möglich ist.
Die Herausforderung besteht darin, dies wirtschaftlich im großen Maßstab umzusetzen – Optimierung des Reagenzieneinsatzes, Umgang mit verschiedenen Batterietypen und Management der Abfallströme.
Hinweis: Lithiumcarbonat (Li₂CO₃) bleibt die am weitesten gehandelte Lithiumverbindung in der Industrie (wobei Lithiumhydroxid an Bedeutung gewinnt). Die Umrechnung lautet: 1 Gramm Lithiummetall ≈ 5,32 Gramm Li₂CO₃.
Mechanochemisches Recycling (Innovation)
Als Antwort auf die Grenzen konventioneller Hydro- und Pyrometallurgie erforschen Wissenschaftler mechanochemische Recyclingmethoden.
Mechanochemie nutzt mechanische Energie (z. B. Hochenergie-Mahlen/Schleifen), um chemische Reaktionen in Feststoffen ohne großen Wärme- oder Lösungsmittelbedarf anzuregen.
Eine bahnbrechende Studie von Dolotko et al. (2023) stellte einen mechanochemisch induzierten Lithiumextraktionsprozess vor, der säurefrei und energieeffizient ist.
Dabei wird das Kathodenmaterial aus gebrauchten LIBs zusammen mit einem Reduktionsmittel (in diesem Fall elementares Aluminium-Pulver, das tatsächlich vom Folienstromabnehmer der Batterie stammt) gemahlen. Durch intensives Mahlen findet eine Reaktion statt, die Lithium-Metalloxide (wie LiCoO₂, LiFePO₄, NMC usw.) reduziert und wasserlösliche Lithiumverbindungen sowie metallische Legierungsnebenprodukte erzeugt. Es wurden zwei Prozessvarianten entwickelt:
- Nach dem Mahlen wird das Pulver direkt in Wasser ausgelaugt.
- Eine andere Variante fügt einen Karbonisierungsschritt hinzu, um Lithiumverbindungen vor dem Auslaugen in Lithiumcarbonat umzuwandeln.
Die wichtigsten Ergebnisse waren sehr vielversprechend:
- Der mechanochemische Ansatz erreichte Lithiumrückgewinnungsraten von bis zu 70–76 % ohne Einsatz von Säuren oder Hochtemperaturofen.
- Wesentlich ist, dass diese Methode bei allen wichtigen Kathodenchemien (LCO, LMO, NMC, LFP) einschließlich Mischungen verschiedener Kathoden wirksam war, was eine große Herausforderung darstellt, da realer Batterieschrott oft eine Mischung von Chemien ist.
- Das Endprodukt war batterietaugliches Li₂CO₃ mit einer Reinheit von etwa 99,9 % nach minimaler Reinigung.
- Mechanochemisches Recycling könnte somit den Bedarf an starken chemischen Auslaugmitteln umgehen und den Prozessfluss vereinfachen.
- Der Energieverbrauch liegt hauptsächlich im Mahlprozess, insgesamt gilt es als energieeffizienter als Pyrometallurgie.
Obwohl noch im Forschungsmaßstab, zeigt dieser Ansatz einen Trend zu umweltfreundlicheren, „lösungsmittelfreien“ Recyclingtechniken. Bei Skalierung könnten mechanochemische Verfahren Recyclinganlagen ermöglichen, Lithium und andere Metalle mit geringeren Emissionen und ohne große Mengen toxischer Abfälle zurückzugewinnen. Dies ist eine spannende Entwicklung, die andere hydrometallurgische Innovationen ergänzt.
Direktes Recycling und Kathodenwiederverwendung
Ein weiterer wichtiger aufkommender Ansatz ist das direkte Recycling (auch direkte Kathodenregeneration genannt).
Im Gegensatz zu metallurgischen Verfahren, die Kathoden in elementare Bestandteile (Metalle oder einfache Salze) zerlegen und dann eine Neusynthese der Kathodenmaterialien erfordern, zielt das direkte Recycling darauf ab, die Struktur und Zusammensetzung der Kathode für die Wiederverwendung zu erhalten. Anders gesagt