Sezioni
- Sistemi per l’estrazione e la raffinazione del litio
- Introduzione al litio
- Usi del litio
- Processi per l’estrazione del litio
- Precipitazione e raffinazione del cloruro di litio
- Evaporatori e cristallizzatori a vuoto per la raffinazione del litio
Sistemi per l’estrazione e la raffinazione del litio
Condorchem Enviro Solutions offre un insieme di soluzioni ad alta efficienza per l’estrazione, purificazione e concentrazione del litio. Il nostro obiettivo principale è offrire una soluzione competitiva e redditizia che permetta alle attività minerarie di soddisfare l’aumento della domanda di litio che hanno sperimentato negli ultimi anni:
Le nostre soluzioni per l’estrazione, purificazione e concentrazione del litio si dividono nei seguenti processi:
- Progettazione di un processo personalizzato per l’estrazione di sali di litio
- Estrazione e purificazione fisico-chimica di effluenti di litio
- Concentrazione e cristallizzazione di sali di litio
- Test di laboratorio: bilancio di materia ed efficienze
- Impianti pilota industriali di dimostrazione
Inoltre, offriamo anche soluzioni integrate per il recupero del litio, così come di altri metalli, nei processi di riciclo di ogni tipo di batterie.
Introduzione al litio
Il litio si trova in natura in circa 145 minerali, ma solo in alcuni può essere considerato in quantità commerciali, oltre a presentarsi in salamoie, acque termali e acqua di mare, in quantità molto diverse che oscillano tra 20 ppm e 65 ppm.
Questo elemento può trovarsi in forme molto diverse, come concentrazioni anomale in pegmatiti; in ambienti sedimentari associati ad argilla; in zone di alterazione idrotermale associate a minerali a basse o alte temperature; in evaporiti non marine; in salamoie di ambienti desertici; in acque salmastre o salamoie associate a giacimenti di petrolio; in giacimenti di boro; berillio, fluoro, manganese e possibilmente fosfato; in ambienti lacustri associati a silicati di magnesio; in acque, piante e suoli di ambienti desertici; in rocce sedimentarie ricche di ferro.
A tutto quanto sopra elencato, va aggiunto che i principali giacimenti in sfruttamento si trovano come pegmatiti o in salamoie di paleo depositi lacustri salini, e la gran parte dei fattori di prospezione verifica solo la presenza di concentrazioni anomale di litio, senza rendimento economico nel mercato attuale.
Il litio ha molteplici applicazioni: fabbricazione di batterie per computer, telefoni cellulari e automobili elettriche (queste ultime aumenteranno enormemente la domanda quando la produzione si diffonderà), specifici farmaci per problemi di disturbi nervosi (antidepressivi), purificazione dell’aria ambiente, leghe per aeronautica (Mg-Li), lubrificanti industriali a base di litio, utilizzo nell’industria nucleare come regolatori di pH del refrigerante, ottenimento di trizio per future generazioni di reattori a fusione nucleare.
Il carbonato di litio (Li2CO3) è il composto di litio più utilizzato; un grammo di litio è contenuto in 5,32 grammi di carbonato di litio.
Ogni anno, solo in Giappone vengono pubblicati studi che contengono ricerche su circa 10.000 nuovi materiali, con proprietà fisiche, chimiche, elettriche, magnetiche, ioniche ed elettrochimiche diverse. Sono in prospettiva lo sviluppo di nuovi prodotti come cianuro, idrossido e litio metallico.
Usi del litio
| Usi del litio | |
| Batterie | 35% |
| Ceramiche, vetri, cementi | 32% |
| Grassi lubrificanti | 9% |
| Condizionamento aria | 5% |
| Usi metallurgici | 5% |
| Sintesi di polimeri | 4% |
| Produzione primaria di alluminio | 1% |
| Altri usi | 9% |
I primi usi commerciali del litio furono in metallurgia impiegando piccole quantità di leghe di alluminio-zinco-litio e leghe di piombo a cui si aggiunge litio per indurirle.
Tra il 1953 e il 1959, la Commissione per l’Energia Atomica degli Stati Uniti consumò grandi quantità di idrossido di litio per separare l’isotopo litio 6, che fu usato nello sviluppo e produzione della bomba all’idrogeno.
Dal 1961 iniziò a svilupparsi l’uso di composti come il bromuro di litio, sotto forma di salamoia concentrata, per apparecchi di condizionamento aria ad assorbimento; il carbonato di litio per l’industria della ceramica; il litio metallico, come intermediario nella sintesi di prodotti farmaceutici; il butil-litio come catalizzatore nella polimerizzazione per la fabbricazione della gomma sintetica.
Si svilupparono nuovi mercati con molteplici scopi, ma rimane ancora oggi il mercato più importante, l’industria delle ceramiche, dove si utilizza il carbonato di litio come agente fondente nella preparazione di smalti smaltati e vetri.
Dal 1974 l’uso del litio metallico come anodo in batterie primarie iniziò a mostrare una rapida crescita, poiché il litio è elettrochimicamente reattivo, oltre a possedere altre proprietà uniche.
Nel 1980 l’industria dell’alluminio superò la ceramica e il vetro come principale utilizzatore in volume di prodotti a base di litio.
Lo sviluppo delle leghe Li-Al ha raggiunto importanti progressi nello sviluppo di nuovi usi, coinvolgendo nella ricerca i produttori di alluminio, aeronautica e militari.
Come risultato, si ottiene una lega più leggera, aggiungendo dall’1,5% al 3% di Li alla lega convenzionale di alluminio, che può essere impiegata in componenti per aerei commerciali e militari; con questo materiale, più leggero del 10%, si risparmia carburante, raggiungendo fino al 20% della capacità di carico dell’aereo.
Attualmente il consumo di litio metallico per queste leghe è dell’ordine di 45 tonnellate all’anno, cioè circa 500.000 libbre all’anno di carbonato di litio.
Recentemente sono state sviluppate piroceramiche che trovano grande applicabilità nell’industria aerospaziale, poiché questo tipo di materiale, contenendo litio, fa sì che le proprietà di espansione e compressione siano quasi nulle se il composto si trova in condizioni estreme di temperatura.
Gli Stati Uniti rimangono il primo produttore di composti di litio a maggior valore aggiunto e il principale consumatore di ogni tipo di materiale a base di litio, con un consumo di 2800 tonnellate metriche di contenuto in litio nell’anno 2000.
I composti di litio soddisfano inoltre le esigenze dell’industria primaria dell’alluminio, componenti di batterie, condizionamento aria, lubrificanti, sistemi di deumidificazione, produzione di tessuti sofisticati, disinfettanti per piscine e bagni, e come candeggianti nelle lavanderie a secco.
La struttura cristallina del litio si stabilizza unicamente a causa delle forze elettrostatiche attrattive tra gli ioni fissi nei siti della rete e gli elettroni liberi, ma poiché esistono pochi elettroni liberi, le forze attrattive che interagiscono non sono molto forti e di conseguenza la rete del litio è debole e facilmente deformabile, originando una durezza molto bassa.
Possiede un basso punto di fusione, 180,5 ºC, tuttavia la quantità di calore richiesta a tale temperatura per distruggere la rete e fondere il metallo è estremamente alta.
Per questa ragione, il litio è utile come assorbitore di calore, particolarmente in sistemi in cui si richiede un basso peso complessivo nel design, il che ha grande importanza nell’industria nucleare come materiale trasportatore di calore in circuito chiuso di reattori.
La facilità con cui il litio cede il suo elettrone esterno determina che sia un agente riducente super potente e, come tale, reagisce velocemente con agenti ossidanti meno potenti, per esempio, reagisce con l’azoto a temperatura ambiente per formare il nitruro Li3N, con l’ossigeno dell’aria reagisce rapidamente formando l’ossido Li2O e con il fluoro genera la reazione più violenta di tutti gli elementi.
A causa di queste proprietà il litio trova applicazioni in sistemi di generazione di energia elettrochimica molto elevata come le batterie litio-cloro o litio-zolfo e vari altri tipi di pile, costituendo attualmente un’industria in espansione.
Il litio è formato dalla combinazione di isotopi, 7,4% di litio 6 e 92,6% di litio 7, che dà un peso atomico isotopico di 6,941.
L’isotopo 6 ha grande importanza, poiché è la materia prima per l’ottenimento del trizio H, che insieme al deuterio H sarebbero i probabili combustibili per reattori a fusione nucleare (Tagger 1983), stimandosi che questi reattori saranno la soluzione al problema energetico mondiale.
Le reazioni di formazione del trizio e di generazione di energia sono le seguenti:
3Li6 + 0n1 — 2He4 + 1H3 + 4,78 Mev
I neutroni provengono a loro volta dalla reazione:
1H2 + 1H3 —- 2He4 + 0n1 R + 17,6 Mev
Dove NL e NR sono neutroni lenti e veloci. Solo i neutroni lenti possono essere efficaci per la conversione del litio 6 in trizio.
Nel campo nucleare, i reattori di tipo PWR stanno valutando la possibilità di utilizzare un altro elemento con effetto neutralizzante e regolatore nel refrigerante che non sia l’idrossido di litio.
A causa del prezzo, attualmente teso dalla domanda di litio nel settore energetico, l’industria nucleare studia la sostituzione con KOH.
La tecnologia di regolazione del pH mediante idrossido di potassio è già stata testata nella tecnologia nucleare russa.
Principali minerali di litio e principali processi estrattivi
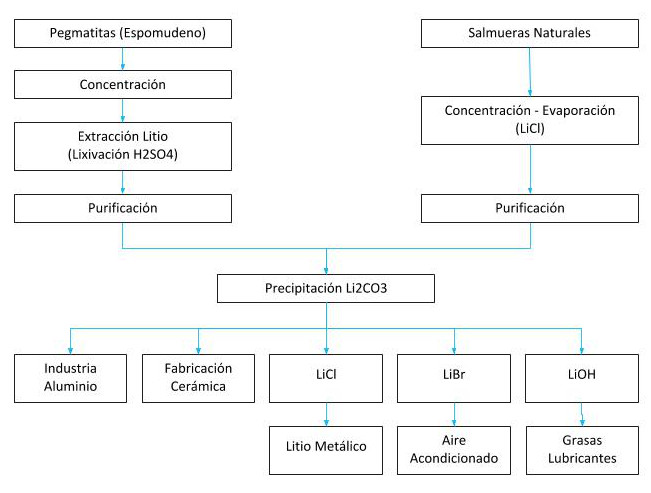
Processi per l’estrazione del litio
Si estrae da salamoie dove esiste in sali naturali come nel Salar de Atacama in Cile, il Salar del Hombre Muerto e altri in Argentina, giacimenti minerali come lo spodumene di Greenbush in Australia o una delle più grandi riserve di litio trovate in Bolivia, 21 milioni di tonnellate metriche nel Salar Boliviano di Uyuni.
Gran parte della produzione mondiale di litio proviene da salamoie, il cui costo di produzione è molto inferiore rispetto ai giacimenti minerali (secondo John McNulty $US 1.500-2300/ton e $US 4.200-4.500/ton rispettivamente).
Il litio si ottiene da due fonti naturali, dal minerale spodumene che è un silicato doppio di alluminio e litio (LiAlSi2O6) che si trova associato a quarzo, mica e feldspato.
L’altra fonte di ottenimento è da salamoie naturali di salares e geyser, trovandosi sotto forma di sali di litio, principalmente solfato doppio di litio e potassio (KLiSO4).
Il litio può essere ottenuto, come detto sopra, da un giacimento di silicato doppio di alluminio e litio (LiAlSi2O6 o Li2O·Al2O3·4SiO2), i cui contenuti sono 3,73% di Li e come ossido 8,03% di Li2O, gli altri elementi sono in rapporto del 51,59% O; 30,18% Si e come ossido di silicio 64,58% SiO2; 14,5% Al e 27,4% Al2O3.
Lo spodumene, noto anche in America come Kunzite, è un cristallo con durezza 6,5 a 7, che presenta una densità di 3,1 g/cc; inoltre possiede la caratteristica di presentare diversi colori, che vanno dal grigio chiaro, giallo, verde fino al porpora.
Le riserve o le risorse di litio della Bolivia sono in salamoie, che hanno una densità approssimativa di 1,2 grammi per litro (g/l), per cui una concentrazione di litio dello 0,1% in peso equivale a 1.000 parti per milione (ppm) e 1,2 g/l di concentrazione del sale di litio.
L’estrazione di salamoie di litio si realizza mediante pompaggio e la concentrazione del litio può essere effettuata tramite due processi.
In primo luogo mediante adsorbimento tramite un adsorbente selettivo per il litio (Polietilenglicole) e in secondo luogo mediante evaporazione in vasche poco profonde costruite a tale scopo.
L’evaporazione oltre ad aumentare la concentrazione dei sali, fa sì che saturandosi alcuni di essi si precipiti.
L’adsorbimento ha i vantaggi di non essere influenzato dalla composizione dell’acqua salata (possono essere trattate salamoie con basse concentrazioni di litio come sperimentalmente si fa con l’acqua di mare), né dalle condizioni meteorologiche del luogo e non genera molti residui; gli svantaggi sono che sono necessari reagenti, l’attrezzatura di adsorbimento è costosa e complicata e il costo dell’adsorbente elevato.
I vantaggi dell’evaporazione naturale sono che non consuma energia né utilizza molti reagenti chimici, mentre gli svantaggi sono la necessità di usare simultaneamente un altro metodo di separazione, l’accumulo di residui e la dipendenza dalle condizioni meteorologiche del luogo (velocità di evaporazione e piogge).
Essendo stato scelto quest’ultimo metodo per il Salar di Uyuni (con cui funzionerà l’impianto pilota già installato), se ne farà solo una breve descrizione.
La maggiore produzione mondiale di litio proviene dalle salamoie del Salar de Atacama in Cile, dove si utilizza il metodo di evaporazione e di cui si hanno dati e molti fattori di operazione, che permettono il confronto con quelli del Salar di Uyuni.
Le salamoie di Atacama sono più ricche di litio rispetto a quelle di Uyuni (anche in potassio e boro), per cui il rapporto Mg/Li, nocivo per la concentrazione del litio, è di 6/1 e 19/1 rispettivamente.
Mentre l’evaporazione e la piovosità sono di 3.200 mm/anno e 10-15 mm/anno ad Atacama, a Uyuni sono di 1.500 mm/anno e 200-500 mm/anno, cioè a Uyuni l’evaporazione è minore e la pioggia molto maggiore, il che rallenterà notevolmente l’evaporazione.
Ad Atacama il processo di evaporazione che concentra il litio dallo 0,15% al 6% (40 volte) dura da 12 a 18 mesi, per cui è prevedibile che a Uyuni l’evaporazione duri molto di più, specialmente con piogge intense come quelle verificatesi ultimamente che hanno allagato le vasche di evaporazione dell’impianto pilota.
| Principali minerali di litio | ||
| Minerale | % Li max. | % Li commerciale |
| Ambligonite | 4.73 | 3.7-4.2 |
| Eucrite | 5.50 | 2.6-3.0 |
| Lepidolita | Variabile | 1.4-1.9 |
| Petalite | 2.26 | 1.4-2.2 |
| Spodumene | 3.73 | 2.6-3.0 |
| Contenuto medio di litio in salamoie sfruttate | ||||||||
| Localizzazione | % Li | % Na | % K | % Mg | % SO4 | % Cl | % B | Li/Mg |
| Bolivia: salar di Uyuni | 0.025 | 8.80 | 0.72 | 0.65 | 0.046 | 15.7 | 0.02 | 1/19 |
| Cile: salar di Atacama | 0.14 | 7.6 | 1.87 | 0.93 | 0.03 | 16 | 0.1 | 1/1.64 |
| Israele-Giordania: Mar Morto | 0.0015 | 3.21 | 0.60 | 3.33 | 1.18 | 17.32 | 0.003 | 1/2200 |
| USA: Great Salt Lake, Utah | 0.004 | 8.0 | 0.65 | 1.00 | 0.016 | 14.0 | 0.006 | 1/250 |
| Silver Peak, NV | 0.023 | 6.2 | 0.53 | 0.033 | 0.20 | 10.06 | 0.008 | 1/1.5 |
A titolo di esempio, con le salamoie ottenute dal Salar de Atacama si è prodotto fino al 1997 solo carbonato di litio, incorporando inoltre dal 1998 il cloruro di litio nel processo produttivo.
L’ottenimento del carbonato, a partire da queste salamoie, potrebbe riassumersi in due fasi: concentrazione delle soluzioni mediante vasche di evaporazione solare: i contenuti iniziali delle salamoie del Salar de Atacama sono intorno allo 0,17% in Li, arrivando a concentrare fino a valori dell’ordine del 4,3% al 5,8% Li.
Trattamento della salamoia concentrata in impianto chimico: per la produzione di Li2CO3 (99,5% di purezza), le salamoie concentrate sono purificate e cristallizzate, poi si realizza un processo di carbonatazione, una successiva precipitazione e infine l’essiccazione dei cristalli.
Il processo applicato dalla Sociedad Chilena de Litio (SCL), appartenente a Foote Mineral Co., sussidiaria di Cyprus Amax Minerals Co, per il recupero del litio è stato sviluppato da questa azienda nel suo impianto a Silver Peak, Nevada (USA), ma adattandolo alle caratteristiche proprie di queste salamoie.
La produzione di Chemetall Foote copre la domanda necessaria per la produzione di composti di litio a maggior valore aggiunto, dai suoi impianti chimici situati negli Stati Uniti e inoltre fornisce le necessità dei suoi affiliati Chemetall in Germania e Taiwan.
Precipitazione e raffinazione del cloruro di litio
Lo studio di laboratorio “Trattamento chimico di salamoie del Salar di Uyuni-Potosí” realizzato nel 1987 in Francia tramite il Convenio UMSA-ORSTOM (Istituto francese di ricerca scientifica per lo sviluppo), simulando in 5 vasche le condizioni delle piscine di evaporazione, stabilì che precipita prima il cloruro di sodio (NaCl) e quasi subito dopo il cloruro di potassio (KCl).
Poiché il cloruro di magnesio (MgCl2) non può essere separato con l’evaporazione, il che complica il processo, viene precipitato come idrossido di magnesio (Mg(OH)2) aggiungendo calce.
Il cloruro di litio adeguatamente concentrato nelle 5 vasche è stato lavato con idrossido di sodio per eliminare le possibili tracce di magnesio e calcio residue, per infine precipitarlo come Cl- utilizzando carbonato di sodio. Il recupero medio del litio fu dell’80,8% e la purezza media del Cl- del 94,4%.
Tre prove di laboratorio recentemente realizzate con 25 litri di salamoia del Salar di Uyuni con 0,107% di litio, presso il National Institute of Advanced Industrial Science and Technology del Giappone, per l’ottenimento di litio con il metodo di adsorbimento, hanno dato Cl- con purezza superiore al 99,8% e un recupero medio del 73%.
Questo metodo è impiegato nel Salar del Hombre Muerto, Argentina, che contiene lo 0,06% di litio.
Il Cl- ottenuto con qualsiasi metodo deve essere purificato, essiccato e cristallizzato. Nonostante l’alto contenuto di litio nel Salar de Atacama e l’esperienza nel suo ottenimento, si indica che il suo recupero è del 42%.
Il Cl- da utilizzare nella fabbricazione di batterie per veicoli elettrici deve avere una purezza di almeno il 99,95%, per cui il Cl- ottenuto per precipitazione deve essere raffinato attraverso varie reazioni e fasi di ricristallizzazione, in alcuni casi mediante una resina a scambio ionico.
Poiché il processo di raffinazione ha un costo e il suo recupero è minore dopo ogni fase (nella fase di raffinazione si stima circa il 70%), maggiore è la purezza del Cl-, maggiore è l’aumento del prezzo.
Sebbene il metodo descritto per l’ottenimento del Cl- sembri semplice, come ogni processo industriale richiede tecnologia e logistica adeguate, tecnici esperti e personale addestrato.
La valutazione del funzionamento dell’impianto pilota permetterà di confermare o modificare il processo di concentrazione del litio mediante piscine di evaporazione.
| Solubilità di Li2CO3 e LiCl in gr/100gr H2O | ||||||||||||
| Temp. ºC | 0 | 5 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 100 |
| Li2CO3 | 1.52 | – | 1.41 | 1.31 | – | 1.24 | 1.16 | 1.07 | 1.00 | – | 0.84 | 0.70 |
| LiCl2 · 2H2O | 40.9 | 42 | 42.7 | – | – | – | – | – | – | – | – | – |
| LiCl2 * H2O | – | – | – | – | 45.85 | 46.3 | 47.3 | 48.3 | 49.6 | 51.1 | 52.8 | 56.511 |
| Fonte: Linke e Siedell, 1965. 1Hutting e Steudemann, 1927 **Presi da Kraus e Burgess, 1929; densità della sol.satura 1.017 a 0ºC e 1.014 15ºC | ||||||||||||
Esempio 1. Processo di trattamento delle salamoie ricche in Li ad Atacama (Cile)
Il carbonato di litio è il composto base più importante tra i sali di Li, la sua domanda rappresenta il 60% dei prodotti di Li.
La sua importanza risiede principalmente nel fatto che è facile da purificare e serve per la conversione di altri sali di litio inorganico e organico come Lico, LiBr e LiOH-H2O e altri composti.
Si stima che la produzione mondiale sia di 45.000 tonnellate annue, essendo il Cile il principale produttore, mentre il principale consumatore di carbonato di litio è gli Stati Uniti.
L’estrazione delle salamoie del Salar de Atacama è stata realizzata dalla Sociedad Chilena del Litio, dal 1984, che dispone di un impianto con capacità di produzione di 11.800 tonnellate all’anno di Li2CO3.
L’estrazione delle salamoie del salar, Figura n.7, si realizza mediante pompe che aspirano la salamoia a 30 m di profondità, scaricandola attraverso tubazioni a un sistema di vasche di evaporazione solare, dove il Li si concentra dallo 0,17% al 4,3%.
La costruzione delle vasche all’interno del salar è stata effettuata rompendo la crosta salina e lasciando una superficie piana su cui giace uno strato di argilla. Sia le dighe che il fondo delle vasche di evaporazione sono stati rivestiti con un plastico resistente di 0,5 mm di spessore.
La protezione del poliuretano si ottiene con uno strato di sali di NaCl di circa 30 cm di spessore. Durante il processo di evaporazione, precipitano sali nelle vasche in modo sequenziale, che vengono raccolti e scartati come impurità: alite (NaCl), silvinite (NaCl + KCl), carnalite (KCl x MgCl2 x 6H2O) e bischofite (MgCl2 x 6H2O).
Nelle vasche a maggiore concentrazione precipita carnalite di litio (LiCl-MgCl2 x 7H2O), con l’obiettivo di recuperare il litio che contiene, viene ripulperata e lavata con una soluzione satura in cloruro di magnesio, ma non satura in cloruro di litio.
La bischofite (MgCl2 x 6H2O) presente e non disciolta viene separata per centrifugazione ed eliminata dal sistema. La salamoia così concentrata raggiunge infine il 5,8% Li, 20% Mg e 0,7% B espresso come acido borico (H3BO3), risultando pronta per essere trasportata all’impianto chimico situato ad Antofagasta a 170 km dal Salar de Atacama.
Il trattamento chimico nell’impianto La Negra consiste nell’eliminare il magnesio residuo, in due fasi di purificazione, come carbonato e idrossido di magnesio, rispettivamente.
Per questo, la salamoia concentrata viene diluita fino a un contenuto dello 0,6% di Li, con l’acqua madre proveniente dalla fase finale di precipitazione del carbonato di litio.
Questo prodotto si ottiene per reazione a caldo (circa 85ºC), tra la salamoia purificata libera da magnesio (1 ppm) e una soluzione di Na2CO3, precipitando il Li2CO3.
Il prodotto finale viene essiccato e commercializzato in cristalli (70%), oppure compattato per essere venduto in forma di granuli (30%).
La purezza del prodotto è vicina al 99,5% Li2CO3. Tuttavia, il suo contenuto in boro (400-600 ppm) ne impedisce l’utilizzo come materia prima per la fabbricazione di litio metallico, tramite cloruro di litio.
2LiCl + Na2CO3 == Li2C03 + 2NaCl
Per risolvere il problema precedente e poter ottenere un carbonato di litio con le specifiche più elevate richieste dal mercato, FOOTE ha progettato un processo che permette di eliminare il boro dalla salamoia, mediante estrazione con solvente, in una fase precedente alla separ