L’inquinamento atmosferico costituisce una grave minaccia per la salute nella maggior parte delle zone del pianeta. Secondo una valutazione del carico di morbilità dovuto all’inquinamento ambientale realizzata dall’OMS, ogni anno si verificano più di 7 milioni di morti premature attribuibili agli effetti dell’inquinamento urbano. Inoltre, non è un problema esclusivo dei paesi più sviluppati, ma più della metà di tale carico ricade sulla popolazione dei paesi in via di sviluppo.
Gli ossidi di azoto non sono gli unici responsabili dell’inquinamento atmosferico, ma sono tra i principali inquinanti per importanza.
Gli ossidi di azoto sono due gas di azoto differenti: ossido nitrico (NO) e biossido di azoto (NO2). Il termine NOX si riferisce alla combinazione dei gas a causa delle facilità di interconversione reciproca che presentano in presenza di ossigeno. Sebbene da un punto di vista formale, il termine generale degli ossidi di azoto includa i seguenti composti:
- NO
- NO2
- N2O2
- N2O4
- N2O
- N2O3
- N2O5
- NO3 (quest’ultimo instabile)
Sebbene gran parte dei NOX sia di origine naturale, una frazione importante di NOX è dovuta a processi antropogenici. Le fonti artificiali più importanti corrispondono al trasporto (70%) e all’industria (25%). I processi industriali che generano maggior quantità di NOX sono quelli dedicati alla produzione di energia, alla combustione di carbone, petrolio o gas naturale e i processi di galvanoplastica e incisione dei metalli. Il NO e il NO2 si formano nei processi in cui, in presenza di azoto e ossigeno dell’aria, si raggiungono temperature superiori a 1200 ºC.
Gli ossidi di azoto hanno tutti in comune il fatto di essere gas inquinanti, per cui le loro emissioni hanno un’incidenza particolare sull’ambiente. I principali effetti che causano sono:
- La distruzione dello strato di ozono stratosferico
- Contributo all’effetto serra
- La produzione di pioggia acida
- La generazione di smog fotochimico
Per tutto ciò, è assolutamente necessario, in primo luogo, minimizzare la loro produzione. E, successivamente, eliminare gli ossidi di azoto che non si è potuto prevenire. L’obiettivo di minimizzare la loro generazione può essere raggiunto seguendo tre strategie differenti:
- Riducendo la temperatura di esercizio
- Riducendo il tempo di permanenza dei gas, specialmente l’azoto, nella zona di combustione, dove esistono elevate temperature
- Diminuendo il rapporto ossigeno-combustibile. Riducendo l’eccesso di ossigeno, si diminuisce considerevolmente la generazione di NOX
Tuttavia, è impossibile evitare completamente la generazione di ossidi di azoto e per rispettare la normativa, che è sempre più severa, si devono utilizzare tecniche che permettano di eliminare i NOX generati. Le tecniche più utilizzate a questo scopo sono:
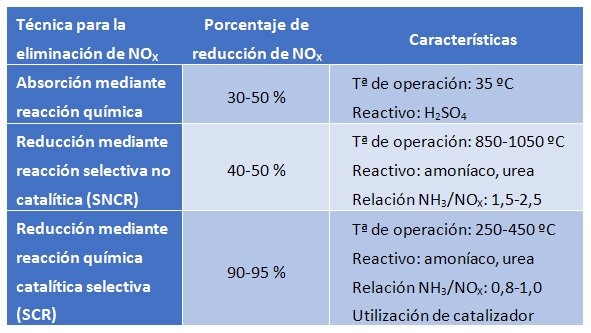
Assorbimento mediante reazione chimica
Questa tecnica consiste nell’assorbimento dei NOX mediante una reazione chimica in fase liquida. Il reagente maggiormente utilizzato per il loro assorbimento è l’acido solforico. Questo reagisce con gli ossidi di azoto per formare la specie HSO4NO (acido nitrosilsolforico), che rimane nella fase liquida. In condizioni di elevata pressione (2 atm) e bassa temperatura (35 ºC) i NOX vengono assorbiti nella fase liquida. Invece, il processo può essere invertito ad alta temperatura (180ºC) e bassa pressione (0,5 atm); in queste condizioni, la molecola azotata (ora acido nitrico per la presenza di acqua) si separa dall’acido solforico, che può essere riutilizzato.
Questo processo presenta lo svantaggio che si devono manipolare reagenti chimici corrosivi e pericolosi, oltre a richiedere spazio fisico per ospitare il processo. Le efficienze ottenute non sono elevate, per cui la tecnica è raccomandabile per basse cariche di NOX.
Riduzione mediante reazione selettiva non catalitica (SNCR)
Questa tecnica permette la riduzione delle emissioni di ossidi di azoto mediante la loro conversione in azoto gassoso tramite una reazione chimica non catalitica. Per effettuare questa conversione, senza la presenza di alcun catalizzatore, è necessario aumentare la temperatura nell’intervallo 850-1100 ºC. La temperatura di esercizio dipende direttamente dall’agente riducente utilizzato, i più usati sono ammoniaca o urea.
Questa tecnica si utilizza solitamente in piccole caldaie industriali, poiché in impianti di maggiori dimensioni i costi di lavorare in questo intervallo di temperature aumentano notevolmente. L’apparecchiatura SNCR non richiede molto spazio ed è di facile installazione e funzionamento. Tuttavia, l’efficienza di riduzione raggiunta è moderata, fatto che rende questa tecnica valida per quei casi in cui le emissioni di ossidi di azoto siano basse.
Riduzione mediante reazione chimica catalitica selettiva (SCR)
Questa tecnica si basa su un processo catalitico in cui si riducono selettivamente gli ossidi di azoto in presenza di un catalizzatore mentre l’agente riducente (ammoniaca o urea) si ossida ad azoto gassoso. Il fatto che la reazione avvenga sulla superficie del catalizzatore rende possibile che la temperatura necessaria sia compresa nell’intervallo 250-450 ºC. La temperatura di esercizio dipenderà da vari fattori, essendo il catalizzatore utilizzato uno dei parametri chiave.
L’agente riducente, in pratica, può essere una soluzione acquosa di ammoniaca, ammoniaca liquefatta o una soluzione acquosa di urea. Tra queste, l’utilizzo di ammoniaca liquefatta è l’opzione più economica, il che si traduce in costi operativi inferiori. Ma d’altra parte, la manipolazione dell’ammoniaca liquefatta è molto più complessa, a causa delle sue caratteristiche, rispetto a una soluzione acquosa di ammoniaca o di urea. L’uso, lo stoccaggio e il trasporto di ammoniaca liquefatta sono soggetti alla Direttiva 96/82/CE (Direttiva Seveso II) e devono essere utilizzati seguendo un rigoroso protocollo di sicurezza, a causa del rischio che comporta il fatto di essere molto corrosiva ed esplosiva in presenza di ossigeno.
A livello operativo, maggiore è il rapporto NH3/NOX alimentato, maggiore sarà l’efficienza ottenuta. Tuttavia, aumenterà anche la quantità di ammoniaca non reagita che si perde nella corrente dei gas. Questa perdita di ammoniaca non reagita deve essere minimizzata, poiché essa reagisce in presenza di acqua con SO3, per produrre bisolfato di ammonio (NH4HSO4), che è corrosivo e provoca l’incrostazione degli impianti. La chiave per un’operazione ottimale è l’alimentazione di ammoniaca in modo tale da ottenere un buon rendimento minimizzando allo stesso tempo la quantità di ammoniaca non reagita.
La scelta del catalizzatore è determinante nel processo, poiché influisce su parametri chiave come la temperatura di esercizio e l’estensione della reazione. Esistono quattro materiali diversi utilizzati come catalizzatori:
- Ossidi metallici (di vanadio, tungsteno, molibdeno o cromo) su base di biossido di titanio (TiO2)
- Zeoliti
- Ossidi di ferro rivestiti da un sottile strato di fosfato di ferro
- Carbone attivo
La scelta del catalizzatore condiziona anche direttamente i costi operativi, poiché non tutti hanno le stesse proprietà, costo e durata.
I principali vantaggi della tecnologia SCR si basano sull’elevata efficienza di eliminazione dei NOX, oltre al fatto che i NOX vengono trasformati in azoto gassoso senza produrre alcun sottoprodotto o residuo.
Pertanto, l’emissione di ossidi di azoto deve essere controllata in quanto è strettamente regolamentata dalla normativa vigente. Il primo passo per il controllo è la minimizzazione della produzione di questi gas. La produzione che non si può prevenire dovrà essere correttamente trattata prima di liberare il resto dei gas nell’atmosfera. Per l’eliminazione dei NOX la tecnica più efficiente è la riduzione mediante reazione chimica catalitica selettiva (SCR).
L’urea
Come abbiamo detto, l’urea si utilizza come agente riducente per eliminare gli ossidi di azoto (NOx) mediante SCR e SNCR, questa illustrazione* mostra l’aspetto di una molecola di urea. L’urea è utilizzata anche come additivo nei veicoli con motore a combustione per neutralizzare, per quanto possibile, le proprie emissioni.
*(credito 3dchem.com)