Seccions
- Sistemes per a l’extracció i refinat del liti
- Introducció al liti
- Usos del liti
- Processos per a l’extracció del liti
- Precipitació i refinació del clorur de liti
- Evaporadors i cristal·litzadors al buit per al refinat del liti
Sistemes per a l’extracció i el refinat del liti
Condorchem Enviro Solutions ofereix un conjunt de solucions d’alta eficiència per a l’extracció, purificació i concentració de liti. El nostre principal objectiu és oferir una solució competitiva i rendible que permeti a les explotacions mineres satisfer l’augment en la demanda de liti que han experimentat en els últims anys:
Les nostres solucions per a l’extracció, purificació i concentració de liti es divideixen en els següents processos:
- Disseny d’un procés personalitzat d’extracció de sals de liti
- Extracció i purificació fisicoquímica d’efluents de liti
- Concentració i cristal·lització de sals de Liti
- Assaigs de laboratori: Balanç de matèria i eficiències
- Plantes pilot industrials de demostració
D’altra banda, també oferim solucions integrals per a la recuperació de liti, així com altres metalls, en processos de reciclatge de tot tipus de bateries.
Introducció al liti
El liti es troba a la natura en aproximadament 145 minerals, però només en alguns pot considerar-se en quantitats comercials, a més de presentar-se en salmorres, aigües termals i aigua de mar, en quantitats molt diferents que oscil·len entre 20 ppm i 65 ppm.
Aquest element pot trobar-se de molt diverses formes, com ser en concentracions anòmales de pegmatites; en ambients sedimentaris associats amb argila; en zones d’alteració hidrotermal associats a minerals a baixes com a altes temperatures; en evaporites no marines; en salmorres d’ambients desèrtics; en aigües salines o salmorres associades a jaciments de petroli; en jaciments de bor, beril·li, fluor, manganès i possiblement fosfat; en ambients lacustres associats a silicats de magnesi; en aigües, plantes i sòls d’ambients desèrtics; en roques sedimentàries riques en ferro.
A tot l’enumerat anteriorment, cal afegir que els principals jaciments que es troben en explotació, s’ubiquen com a pegmatites o en salmorres de paleo dipòsits lacustres salins, i la gran majoria dels factors de prospecció només comproven la presència de concentracions anòmales de liti, sense rendiment econòmic en el mercat actual.
El liti té múltiples aplicacions: Fabricació de bateries per a ordinadors, telèfons mòbils i automòbils elèctrics (aquests pujaran la seva demanda en extrem quan es massifiqui la seva producció), específics farmacèutics per a problemes de trastorns nerviosos (antidepressius), purificació de l’aire ambient, aliatges per a aeronàutica (Mg-Li), lubricants industrials de base liti, utilització en la indústria nuclear com a reguladors de pH del refrigerant, obtenció de triti per a futures generacions de reactors de fusió nuclear.
El carbonat de liti (Li2CO3) és el compost de liti més utilitzat; un gram de liti està contingut en 5,32 grams de carbonat de liti.
Cada any, només al Japó es publiquen treballs que contenen estudis d’al voltant de 10.000 nous materials, amb propietats físiques, químiques, elèctriques, magnètiques, iòniques i electroquímiques diferents. Estan en perspectiva el desenvolupament de nous productes com el cianur, hidròxid i liti metàl·lic.
Usos del liti
| Usos del liti | |
| Bateries | 35% |
| Ceràmiques, vidres, ciments | 32% |
| Grasses lubricants | 9% |
| Aire condicionat | 5% |
| Usos metal·lúrgics | 5% |
| Síntesi de polímers | 4% |
| Producció primària d’alumini | 1% |
| Altres usos | 9% |
Els primers usos comercials del liti van ser en metal·lúrgia emprant petites quantitats d’aliatges d’alumini-zinc-liti i aliatges de plom en els quals s’afegeix liti per endurir-los.
Entre els anys 1953 i 1959, la Comissió d’Energia Atòmica dels Estats Units va consumir grans quantitats d’hidròxid de liti per separar l’isòtop liti 6, que va ser usat en el desenvolupament i producció de la bomba d’hidrogen.
Des de 1961 va començar a desenvolupar-se l’ús de compostos com el bromur de liti, en forma de salmorra concentrada, per a equips d’aire condicionat per absorció; el carbonat de liti per a la indústria de ceràmica; el liti metàl·lic, com a intermediari en la síntesi de productes farmacèutics; el Butil-liti com a catalitzador en la polimerització de la fabricació del cautxú sintètic.
Nous mercats es van desenvolupar amb múltiples propòsits, però segueix sent avui dia, el mercat més important, la indústria de les ceràmiques, on s’utilitza el carbonat de liti com a agent fundent en la preparació d’esmaltats envernissats i vidres.
Des de 1974 l’ús del liti metàl·lic com ànode en bateries primàries va començar a mostrar un ràpid creixement, ja que, el liti és electroquímicament reactiu, a més de posseir altres propietats úniques.
El 1980 la indústria de l’alumini va desplaçar del primer lloc la ceràmica i vidre com a principal usuari en volum de productes de liti.
El desenvolupament dels aliatges de Li-Al, aconsegueixen importants avenços en el desenvolupament de nous usos, incorporant la participació a la recerca als productors d’alumini, aeronàutica i militars.
Com a resultat, s’aconsegueix un aliatge més lleuger, afegint l’1,5% al 3 % de Li a l’aliatge convencional d’alumini, que pot ser emprat en components per a avions comercials i militars, amb aquest material un 10% més lleuger, s’estalvia combustible, per assolir fins a un 20% de la capacitat de càrrega de l’avió.
Actualment el consum de liti metàl·lic per a aquests aliatges és de l’ordre de 45 tones anualment, és a dir unes 500.000 lliures per any de carbonat de liti.
En l’últim temps, s’han desenvolupat piroceràmiques que troben una gran aplicabilitat en la indústria aeroespacial, ja que aquest tipus de material, en contenir liti, fan que les propietats d’expansió i compressió siguin gairebé nul·les, si el compost es troba sota condicions extremes de temperatura.
Els Estats Units segueixen sent el primer productor de compostos de major valor afegit de liti i el principal consumidor de tot tipus de materials de liti, amb un consum de 2800 tones mètriques de contingut en liti l’any 2000.
Els compostos de liti a més satisfan les necessitats de la indústria primària d’alumini, components de bateries, aire condicionat, lubricants, sistemes de deshumidificació, producció de tèxtils sofisticats, desinfectants per a piscines i banys, i com a blanquejadors en bugaderies en sec.
L’estructura cristal·lina del liti s’estabilitza únicament a causa de les forces electrostàtiques atractives entre els ions fixos en els llocs de la xarxa i els electrons lliures, però com només existeixen pocs electrons lliures, les forces atractives que interactuen no són molt fortes i per tant la xarxa de liti és dèbil i fàcilment deformable originant molt baixa duresa.
Posseeix un punt de fusió baix, 180,5 ºC, però la quantitat de calor que requereix a aquesta temperatura per destruir la xarxa i fondre el metall, és extremadament alta.
Per aquesta raó, el liti és útil com a resumidor de calor, particularment en sistemes en què es requereix un pes global baix en el disseny, cosa que té gran importància en la indústria nuclear com a material transportador de calor en circuit tancat de reactors.
La facilitat amb la qual el liti cedeix el seu electró exterior, determina que sigui un agent reductor súper potent i, com a tal, reacciona ràpidament amb els agents oxidants menys potents, per exemple, reacciona amb el nitrogen a temperatura ambient per formar el nitrur Li3N, amb l’oxigen de l’aire reacciona ràpidament formant l’òxid Li2O i amb el fluor genera la reacció més violenta de tots els elements.
A causa d’aquestes propietats el liti troba aplicacions en sistemes de molt alta generació d’energia electroquímica com les bateries de liti-clor o de liti-sulfur i diversos altres tipus de piles, constituint actualment una indústria en expansió.
El liti està format per la combinació d’isòtops, 7,4 % de liti 6 i 92,6 % de liti 7, cosa que dóna un pes atòmic isotòpic de 6,941.
L’isòtop 6 té gran importància, ja que és la matèria primera per a l’obtenció del triti H, que juntament amb el deuteri H serien els probables combustibles reactors de fusió nuclear (Tagger 1983), estimant-se que aquests reactors seran la solució del problema energètic del món.
Les reaccions de formació del triti i de generació d’energia són les següents:
3Li6 + 0n1 — 2He4 + 1H3 + 4,78 Mev
Els neutrons provenen al seu torn de la reacció:
1H2 + 1H3 —- 2He4 + 0n1 R + 17,6 Mev
On NL i NR són neutrons lents i ràpids. Només els neutrons lents poden ser eficaços per a la conversió del liti 6 en triti.
En el camp nuclear, els reactors del tipus PWR estan avaluant la possibilitat d’utilitzar un altre element d’efecte neutralitzant i regulador en el refrigerant que no sigui l’hidròxid de liti.
A causa del preu, que actualment es troba tensionat per la demanda de liti en el sector energètic, la indústria nuclear estudia la substitució per KOH.
La tecnologia de regulació de pH mitjançant l’hidròxid de potassi ja està provada en la tecnologia nuclear russa.
Minerals principals de Liti i principals processos extractius
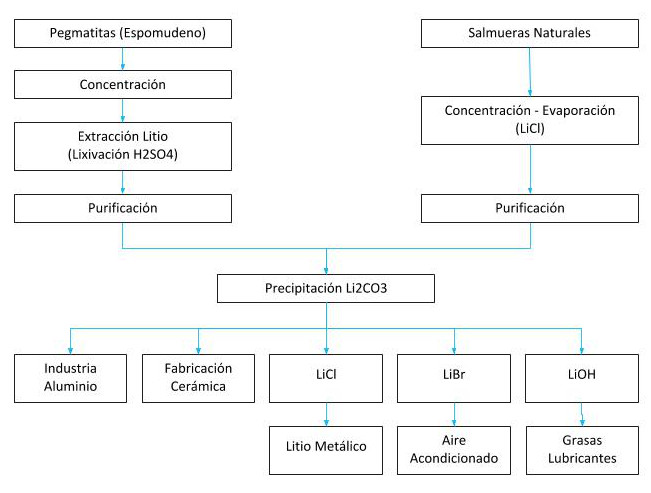
Processos per a l’extracció del liti
S’extreu de salmorres on existeix en sals naturals com al Salar d’Atacama a Xile, el Salar del Hombre Muerto i altres a l’Argentina, dipòsits minerals com l’espodumè de Greenbush a Austràlia o una de les més grans reserves de liti trobades a Bolívia, 21 milions de tones mètriques al Salar Bolivià d’Uyuni.
Gran part de la producció mundial de liti prové de salmorres, el cost de producció de les quals és molt menor que el dels dipòsits minerals (segons John McNulty $US 1.500-2300/ton i $USn4.200-4.500/ton respectivament).
El liti s’obté a partir de dues fonts naturals, del mineral espodumè que és un silicat doble d’alumini i liti (LíAISi2O6) que es troba associat amb el quars, mica i feldspat.
L’altra font d’obtenció és a partir de salmorres naturals dels salars i geysers, trobant-se en forma de sals de liti, principalment, sulfats dobles de liti i potassi (KLiSO4).
El liti pot obtenir-se, com s’ha esmentat anteriorment, a partir d’un jaciment de silicat doble d’alumini i liti (LiAlSi2O6 o Li2O·Al2O3·4SiO2), els continguts dels quals són 3,73% de Li i com a òxid 8,03% de Li2O, els altres elements estan en relació del 51,59% O; 30,18% Si i com a òxid de silici 64,58% SiO2; 14,5% Al i 27,4% Al2O3.
L’espodumè, també conegut a Amèrica com Kunzita, és un cristall de duresa 6,5 a 7, que presenta una densitat 3,1 g/cc; a més posseeix la característica de presentar diversos colors, que van des de gris clar, groc, verd fins a porpra.
Les reserves o els recursos de liti de Bolívia estan en salmorres, que tenen una densitat aproximada a 1,2 grams per litre (g/l), per la qual cosa una concentració de liti de 0,1% en pes equivaldrà a 1.000 parts per milió (ppm) i 1,2 g/l de concentració de la sal de liti.
L’extracció de salmorres de liti es realitza mitjançant bombeig i la concentració del liti es pot realitzar mitjançant dos processos.
En primer lloc per mitjà de l’adsorció mitjançant un adsorbent selectiu del liti (Polietilenglicol) i en segon lloc mitjançant l’evaporació en piscines poc profundes construïdes per a l’efecte.
L’evaporació a més d’elevar la concentració de les sals, fa que en saturar-se algunes d’aquestes es vagin precipitant.
L’adsorció té els avantatges que no és influïda per la composició de l’aigua salada (pot tractar-se salmorres amb baixes concentracions de liti com experimentalment es fa amb l’aigua de mar), ni per les condicions meteorològiques del lloc i no es generen molts residus i els desavantatges que són necessaris reactius, l’equip d’adsorció és car i complicat i el cost de l’adsorbent elevat.
Els avantatges de l’evaporació natural són que no es consumeix energia ni s’utilitzen molts reactius químics, mentre que els seus desavantatges són la necessitat d’utilitzar simultàniament un altre mètode de separació, l’acumulació de residus i la dependència de les condicions meteorològiques del lloc (velocitat d’evaporació i pluges).
Havent-se triat aquest últim mètode per al Salar d’Uyuni (amb el qual funcionarà la planta pilot ja instal·lada), només es farà una breu descripció d’aquest.
La major producció mundial de liti prové de les salmorres del Salar d’Atacama a Xile, on s’utilitza el mètode d’evaporació i del qual es tenen dades i molts factors d’operació, que permeten la seva comparació amb els del Salar d’Uyuni.
Les salmorres d’Atacama són més riques que les d’Uyuni en liti (també en potassi i bor), per la qual cosa la relació Mg/Li, nociu per a la concentració del liti és de 6/1 i 19/1 respectivament.
Mentre que l’evaporació i la pluviometria són de 3.200 mm/any i 10-15 mm/any a Atacama, a Uyuni són de 1.500 mm/any i 200-500 mm/any, és a dir que a Uyuni l’evaporació és menor i la pluja molt més gran, cosa que retardarà força l’evaporació.
A Atacama el procés d’evaporació que concentra el liti de 0,15% a 6% (40 vegades) dura de 12 a 18 mesos, per la qual cosa és de preveure que a Uyuni l’evaporació duri molt més, especialment amb pluges intenses com les ocorregudes últimament que van anegar les piscines d’evaporació de la planta pilot.
| Principals minerals de liti | ||
| Mineral | % Li màx. | % Li comercial |
| Ambligonita | 4.73 | 3.7-4.2 |
| Eucriptia | 5.50 | 2.6-3.0 |
| Lepidolita | Variable | 1.4-1.9 |
| Petalita | 2.26 | 1.4-2.2 |
| Espodumè | 3.73 | 2.6-3.0 |
| Contingut mitjà de liti en salmorres explotades | ||||||||
| Localització | % Li | % Na | % K | % Mg | % SO4 | % Cl | % B | Li/Mg |
| Bolívia: salar d’Uyuni | 0.025 | 8.80 | 0.72 | 0.65 | 0.046 | 15.7 | 0.02 | 1/19 |
| Xile: salar d’Atacama | 0.14 | 7.6 | 1.87 | 0.93 | 0.03 | 16 | 0.1 | 1/1.64 |
| Israel-Jordània: Mar Mort | 0.0015 | 3.21 | 0.60 | 3.33 | 1.18 | 17.32 | 0.003 | 1/2200 |
| EEUU: Great Salt Lake, Utah | 0.004 | 8.0 | 0.65 | 1.00 | 0.016 | 14.0 | 0.006 | 1/250 |
| Silver peak, NV | 0.023 | 6.2 | 0.53 | 0.033 | 0.20 | 10.06 | 0.008 | 1/1.5 |
A mode d’exemple amb les salmorres obtingudes del Salar d’Atacama s’ha produït fins 1997 només carbonat de liti, incorporant a més a partir de 1998, el clorur de liti en el seu procés productiu.
L’obtenció del carbonat, a partir d’aquestes salmorres podria resumir-se en dues etapes: Concentració de les solucions, mitjançant basses d’evaporació solar: Els continguts inicials de les salmorres del Salar d’Atacama són al voltant de 0,17 % en Li, arribant-se a concentrar fins a valors de l’ordre de 4,3 % a 5,8% Li.
Tractament de la salmorra concentrada en planta química: Per a la producció del Li2CO3 (99,5% de puresa), les salmorres concentrades són purificades i cristal·litzades, després es realitza un procés de carbonatació, una posterior precipitació i finalment l’assecat dels cristalls.
El procés aplicat per la Societat Xilena de Liti (SCL), pertanyent a Foote Mineral Co., subsidiària de Cyprus Amax Minerals Co, per a la recuperació de liti va ser desenvolupat per aquesta empresa a la seva planta a Silver Peak, Nevada (U.S.A.), però adaptant-lo a les característiques pròpies d’aquestes salmorres.
La producció de Chemetall Foote, cobreix la demanda necessària per a la producció de compostos de liti amb major valor afegit, de les seves plantes químiques ubicades als Estats Units i a més, subministra les necessitats dels seus parents Chemetall a Alemanya i Taiwan.
Precipitació i refinació del Clorur de liti
L’estudi de laboratori “Tractament químic de salmorres del Salar d’Uyuni-Potosí” realitzat el 1987 a França mitjançant el Conveni UMSA-ORSTOM (Institut francès de recerca científica per al desenvolupament), simulant en 5 vasos les condicions de les piscines d’evaporació, va establir que precipita primer el clorur de sodi (NaCl) i gairebé de seguida el clorur de potassi (KCl).
Com que el clorur de magnesi (MgCl2) no pot ser separat amb l’evaporació, cosa que complica el procés, es precipita com a hidròxid de magnesi (Mg(OH)2) afegint calç.
El clorur de liti adequadament concentrat en els 5 vasos va ser rentat amb hidròxid de sodi per eliminar les possibles traces de magnesi i calci restants, per finalment precipitar-lo com a Cl- utilitzant carbonat de sodi. La recuperació mitjana del liti va ser del 80,8% i la puresa mitjana del Cl- 94,4%.
Tres proves de laboratori recentment realitzades amb 25 litres de salmorra del Salar d’Uyuni amb 0,107% de liti, a l’National Institute of Advanced Industrial Science and Technology del Japó, per a l’obtenció de liti pel mètode d’adsorció, van donar Cl- amb una puresa superior al 99,8% i una recuperació mitjana del 73%.
Aquest mètode s’empra al Salar del Hombre Muerto, Argentina, que conté 0,06% de liti.
El Cl- obtingut per qualsevol mètode ha de ser purificat, assecat i cristal·litzat. Malgrat l’alt contingut de liti al Salar d’Atacama i l’experiència en la seva obtenció, s’indica que la seva recuperació és del 42%.
El Cl- a utilitzar en la fabricació de bateries per a vehicles elèctrics ha de tenir una puresa d’almenys 99,95%, per la qual cosa el Cl- obtingut per precipitació ha de ser refinat a través de diverses reaccions i etapes de recristal·lització, en alguns casos mitjançant una resina d’intercanvi iònic.
A causa que el procés de refinació té cost i la seva recuperació és menor després de cada etapa (en l’etapa de refinació s’estima en aproximadament 70%), com més gran sigui la puresa del Cl-, el seu preu s’incrementa en molt major proporció.
Encara que el mètode descrit per a l’obtenció de Cl- sembla senzill, com tot procés industrial requereix de tecnologia i logística adequades, de tècnics experimentats i personal entrenat.
L’avaluació del funcionament de la planta pilot permetrà confirmar o canviar el procés de concentració de liti mitjançant piscines d’evaporació.
| Solubilitats del Li2CO3 i LiCl en gr/100gr H2O | ||||||||||||
| Temp. ºC | 0 | 5 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 100 |
| Li2CO3 | 1.52 | – | 1.41 | 1.31 | – | 1.24 | 1.16 | 1.07 | 1.00 | – | 0.84 | 0.70 |
| LiCl2 · 2H2O | 40.9 | 42 | 42.7 | – | – | – | – | – | – | – | – | – |
| LiCl2 * H2O | – | – | – | – | 45.85 | 46.3 | 47.3 | 48.3 | 49.6 | 51.1 | 52.8 | 56.511 |
| Font: Linke i Siedell, 1965. 1Hutting and Steudemann, 1927 **Presos per Kraus and Burgess, 1929; densitat de la sol.saturada 1.017 a 0ºC i 1.014 15ºC | ||||||||||||
Exemple 1. Procés de tractament de les salmorres riques en Li a Atacama (Xile)
El carbonat de liti, és el compost base més important entre les sals de Li, la seva demanda representa el 60% dels productes de Li.
La seva importància principalment rau en què és fàcil de purificar i serveix per a la conversió d’altres sals de liti inorgànic i orgànic com, Lico, LiBr i LiOH-H2O i altres compostos.
S’estima que la producció mundial és de 45.000 tones anuals, sent Xile el principal productor, mentre que el principal consumidor de carbonat de liti és els Estats Units.
L’extracció de les salmorres del Salar d’Atacama ha estat realitzada per la Societat Xilena del Liti, des de 1984, la qual compta amb una planta amb capacitat de producció de 11.800 tones a l’any de Li2CO3.
L’extracció de les salmorres del salar, Figura Nº7, es realitza mitjançant bombes que succionen la salmorra a 30m de profunditat, descarregant-les a través de canonades a un sistema de basses d’evaporació solar, on el Li es concentra des de 0,17% a 4,3%.
La construcció de les basses dins del salar, es va efectuar trencant la crosta salina i deixant una superfície plana en la qual hi ha una capa d’argila. Tant els dics com el fons de les basses d’evaporació es van revestir amb un plàstic resistent de 0,5mm de gruix.
La protecció del poliuretà s’aconsegueix amb una capa de sals de NaCl d’aproximadament 30cm de gruix. Durant el procés d’evaporació, precipiten sals a les basses en forma seqüencial, les quals són collides i descartades com a impureses: halita (NaCl), silvinita (NaCl + KCl), carnalita (KCl x MgCl2 x 6H2O) i bischofita (MgCl2 x 6H2O).
A les basses de major concentració precipita carnalita de liti. (LiCl-MgCl2 x 7H2O), amb l’objectiu de recuperar el liti que conté, és repulpejada i rentada amb una solució saturada en clorur de magnesi, però no saturada en clorur de liti.
La bischofita (MgCl2 x 6H2O) present i no dissolta, es separa per centrifugació i és eliminada del sistema. La salmorra finalment així concentrada arriba al 5,8% Li, 20% Mg i 0,7% B expressada com a àcid bòric (H3BO3), trobant-se llesta per ser transportada a la planta química ubicada a Antofag