Sezioni
- Introduzione
- Caratteristiche del boro
- Principali produttori mondiali
- Impatto del boro sull’ambiente
- Trattamento degli effluenti con boro
- Riassunto
Introduzione
Il boro è un metalloide che si combina facilmente in diverse forme grazie ai suoi tre elettroni liberi nell’ultimo orbitale, che gli conferiscono un carattere molto reattivo. I composti del boro (dall’arabo buraq e da qui dal persiano burah) sono conosciuti da migliaia di anni. Nell’antico Egitto, la mummificazione dipendeva dal natron, un minerale che conteneva borati e altri sali comuni.
In Cina si usavano già cristalli di borace intorno al 300 a.C., e nell’antica Roma si utilizzavano composti di boro nella fabbricazione del vetro. A partire dall’VIII secolo i borati furono usati nei processi di raffinazione dell’oro e dell’argento.
Nel 1808 Humphry Davy, Gay-Lussac e L. J. Thenard ottennero boro con una purezza approssimativa del 50%, anche se nessuno di loro riconobbe la sostanza come un nuovo elemento, cosa che fece Jöns Jacob Berzelius nel 1824.
Il boro puro fu prodotto per la prima volta dal chimico statunitense W. Weintraub nel 1909.
L’importanza dei prodotti del boro si riflette nella grande varietà di applicazioni che possiedono. I principali usi dei borati e dei composti di boro sono: nell’industria degli smalti e delle ceramiche (sanitari, stoviglie, ceramiche, piastrelle), industria del vetro, cristalli e fibre di vetro, vetri Pyrex per utensili, lampade e lampadine, detergenti e sbiancanti, ritardanti di fiamma, abrasivi, cosmetici, nella conservazione del legno, in capacitori, leghe, catalisi, gomma (ignifuga), cemento (diminuisce la velocità di indurimento), combustibile (borano per aerei e razzi), concerie (evita putrefazione), farmacia (antisettico delicato), pitture (fungicida), applicazioni nucleari, in ottica, ecc. Oltre a questi usi industriali, il boro è uno dei 7 micronutrienti essenziali per le piante, per cui la dosificazione del boro come fertilizzante assume grande importanza.
Il borofene è uno dei materiali di tendenza. Circa 5-6 anni fa, il grafene sembrava catturare l’interesse mondiale a livello di materiali all’avanguardia per lo sviluppo tecnologico, ma attualmente il borofene si propone come un grande candidato a spodestarlo, soprattutto nel campo della nanotecnologia.
Il boro nella crosta terrestre
La concentrazione stimata del boro nella crosta terrestre è di 10 ppm, e la sua massa di 2,4 × 1017 kg.
Attualmente si sa che il boro è molto più abbondante nelle rocce sedimentarie (300 ppm) che nelle rocce ignee (3 ppm), questa differenza è conseguenza di quattro caratteristiche: il boro è sublimabile, la non preferenza del boro per le fasi fuse (elemento incompatibile), la sua alta mobilità nella fase acquosa e la sua forte affinità per i minerali argillosi (elemento litofilo).
Il boro arriva nella crosta terrestre attraverso diverse vie, che sono la precipitazione atmosferica, che contiene piccole quantità di boro in soluzione; e il vulcanismo e l’attività geologica analoga, che liberano roccia fusa con concentrazioni variabili di boro.
Ci sono anche flussi dall’oceano alla crosta oceanica sotto forma di sedimentazione e diagenesi. Le vie di uscita del boro dalla crosta sono l’erosione e i processi di subduzione delle placche.
Il boro tende a concentrarsi nelle fasi residue della parte fusa, gli elementi che compongono la massa di magma solidificano in funzione del loro punto di fusione e della loro compatibilità con la fase solida, in questo modo, negli stadi successivi della solidificazione, la concentrazione degli elementi incompatibili (tra cui il boro) aumenta nel magma, fino a quando si ha un liquido formato da elementi incompatibili che finiscono per solidificarsi.
Questi depositi di elementi incompatibili sono quelli che conosciamo con il nome di pegmatiti. Seguendo questo fatto, le concentrazioni di boro sono relativamente basse nei basalti (6-0,1 ppm) e più alte nelle rocce più cristallizzate come il granito (85 ppm), anche se si trovano alte concentrazioni di boro in graniti derivati da rocce sedimentarie ricche di boro. Le pegmatiti possono contenere concentrazioni di boro di 1360 ppm.
Durante il deterioramento delle rocce sottomarine, le rocce ignee si degradano e formano minerali argillosi che adsorbono boro dall’acqua marina, arricchendo così la massa di roccia.
I basalti delle isole magmatiche tendono a essere arricchiti in boro; questo arricchimento è attribuito alla disidratazione dei blocchi rocciosi subdotti, ricchi di boro adsorbito da minerali argillosi.
Le frazioni ricche di boro partecipano al processo di fusione e le rocce vulcaniche risultanti (andesiti e dioriti) sono conseguentemente arricchite in boro. Minerali argillosi (come illiti, smectiti e montmorilloniti) incorporano boro dall’acqua sia per adsorbimento sia come elemento di sostituzione nella struttura.
Le rocce sedimentarie degli oceani tendono a contenere più boro rispetto alle rocce sedimentarie fluviali poiché l’acqua marina contiene una concentrazione maggiore di boro rispetto alle acque continentali.
Il boro è adsorbito solo a temperature inferiori a 40 °C, a temperature più alte (>150 °C) può essere rilasciato dal minerale, perciò, durante il metamorfismo delle rocce sedimentarie gran parte del boro adsorbito viene rilasciato nell’acqua, e se il metamorfismo aumenta ulteriormente il boro come elemento sostituto viene anch’esso rilasciato, pertanto i sedimenti metamorfi tendono a contenere concentrazioni di boro molto inferiori rispetto alle rocce sedimentarie equivalenti.
I principali minerali in cui troviamo boro sono per lo più rocce evaporitiche, come il borace, altamente solubile in acqua; la colemanite; la kernite (una forma parzialmente disidratata del borace) e l’ulexite.
Esistono anche importanti minerali di boro sotto forma di giacimenti di rocce ignee, la datolite, il chorlo e l’elbanite, questi minerali si classificano nel gruppo dei borati (sali inorganici composti da boro e altri ioni), eccetto gli ultimi due minerali menzionati, che appartengono al gruppo delle turmaline, che appaiono specialmente in filoni di tipo pegmatitico.
Il boro nell’idrosfera
Il boro si trova nell’acqua marina in concentrazioni stimate di 4,6 ppm e in una massa di 5,4 × 1015 kg.
Si presenta come componente di due molecole idratate; il B(OH)3 trigonale e il B(OH)4- tetraedrico.
La proporzione delle due forme dipende dal pH dell’acqua di mare e l’equilibrio tra le concentrazioni delle due forme si trova a pH 8,7-8,8, in ambienti più basici predomina la forma tetraedrica e in ambienti più acidi quella trigonale.
A causa del lungo tempo di residenza del boro nell’acqua di mare (25 milioni di anni), le concentrazioni di B(OH)3 e B(OH)4- non variano significativamente nei diversi oceani.
Il boro arriva nell’idrosfera dai continenti tramite il ciclo dell’acqua e per processi di erosione delle rocce, e dalla crosta oceanica per circolazione idrotermale, inoltre proviene anche dalla precipitazione atmosferica.
Il boro nell’atmosfera
L’atmosfera contiene circa 2,7 × 108 kg di boro. Questo si trova nella troposfera in stato gassoso al 97%; il restante 3% si trova in stato solido sotto forma di particelle.
I tempi di residenza considerati per il boro troposferico nella sua forma gassosa sono da 19 a 36 giorni, per il boro particolato da 2 a 6 giorni. A causa di questi tempi di residenza così bassi le concentrazioni di boro sono variabili in diversi punti dell’atmosfera.
Il boro arriva nell’atmosfera attraverso l’evaporazione dell’acqua marina, quindi può tornare agli oceani o ai continenti tramite precipitazione.
Il boro nelle piante
Per le piante il boro è un nutriente essenziale. Sembra avere un ruolo fondamentale nel mantenimento della struttura della parete cellulare (mediante formazione di gruppi cis-diol) e delle membrane.
È un elemento poco mobile nel floema, perciò i sintomi di carenza solitamente appaiono nelle foglie giovani e quelli di tossicità nelle foglie mature.
Un eccesso di boro è dannoso per alcune piante poco tolleranti a questo elemento, potendo agire sulle nervature indebolendole. Nei meli e peri la carenza di boro si manifesta nei frutti come una malformazione interna.
Caratteristiche del boro
Le principali caratteristiche fisiche e chimiche del boro sono le seguenti:
| Nome, simbolo, numero | Boro, B, 5 |
| Serie chimica | Metalloidi |
| Gruppo, periodo, blocco | 13, 2, p |
| Massa atomica | 10,811(7) u |
| Configurazione elettronica | [He]2s22p1 |
| Durezza Mohs | 9,5 |
| Elettroni per livello | 2, 3 |
| Raggio medio | 85 pm |
| Elettronegatività | 2,04 (scala di Pauling) |
| Raggio atomico (calc) | 87 pm (raggio di Bohr) |
| Raggio covalente | 82 pm |
| Stato(i) di ossidazione | 3 (leggermente acido) |
| Stato ordinario | Solido (non magnetico) |
| Densità | 2460 kg/m3 |
| Punto di fusione | 2349 K (2076 ℃) |
| Punto di ebollizione | 4200 K (3927 ℃) |
Il boro presenta molteplici forme allotropiche che hanno come elemento strutturale comune un icosaedro regolare. L’ordinamento degli icosaedri può essere di due forme distinte:
- Unione di due icosaedri per due vertici, mediante legami covalenti normali B – B
- Unione di tre icosaedri per tre vertici, mediante un legame a tre centri con due elettroni.
All’interno di queste possibili unioni, nel boro cristallino gli icosaedri possono associarsi in vari modi per originare gli allotropi corrispondenti:
- Boro tetragonale (T – 50): formato da 50 atomi di boro per cella unitaria, che sono quattro unità icosaedriche unite tra loro da alcuni legami B – B e da due atomi di boro elementare che agiscono come unione tetraedrica tra icosaedri. Possiede una densità di 2,31 g/cm3.
- Boro romboedrico alfa (R – 12): è formato da lastre di icosaedri unite parallelamente. Le unioni intralamellari si effettuano tramite legami a tre centri, mentre le unioni interlamellari avvengono tramite legami a due centri. La densità di questo tipo di boro è di 2,46 g/cm3, e presenta un colore rosso chiaro.
- Boro romboedrico beta (R – 105): formato da dodici icosaedri B12 ordinati in forma icosaedrica intorno a un’unità centrale di B12, cioè B12(B12)12. Presenta una densità di 2,35 g/cm3.
Isotopi del boro
In natura si trovano due isotopi del boro, 11B (80,1%) e 10B (19,9%).
I risultati delle loro masse si differenziano in un’ampia gamma di valori che si definiscono come la differenza tra le frazioni 11B e 10B e tradizionalmente espressa in parti per mille, in acque naturali che vanno da -16 a 59.
Esistono 13 isotopi conosciuti del boro, l’isotopo di durata più breve è 7B che si decompone tramite emissione di protoni e decadimento alfa.
Ha una vita media di 3.5×10−22s. La frazionamento isotopico del boro è controllato dalle reazioni di scambio dei composti speciali B(OH)3 e B(OH)4.
Gli isotopi del boro si frazionano anche durante la cristallizzazione dei minerali, durante i cambiamenti di fase di H2O in sistemi idrotermali, e durante l’alterazione idrotermale delle rocce.
Principali produttori mondiali
Il boro dà origine a diversi composti, da ossidi semplici a strutture molto complesse di tipo polimerico.
Tra questi si trovano gli ossidi denominati borati. I giacimenti di borati di importanza commerciale si localizzano solo in un numero ridotto di regioni geografiche nel mondo: Anatolia (Turchia), California e Nevada (sud-ovest degli Stati Uniti), la Puna Sudamericana (sud del Perù, sud-ovest della Bolivia, nord del Cile e nord-ovest dell’Argentina), Inder (Russia) e Asia Centrale (Cina e Russia).
La Puna Sudamericana possiede le terze riserve mondiali di borati, dopo la Turchia e la costa ovest degli Stati Uniti.
I giacimenti della Puna Sudamericana producono preferibilmente ulexite, tincal, colemanite e idroboracite. Questi costituiscono il minerale utile, di valore commerciale, che si trova mescolato con altri materiali senza valore che costituiscono la ganga, dai quali deve essere separato.
L’ulexite è un borato di sodio e calcio, poco solubile in acqua fredda, accompagnato da ganga costituita da sabbie, argille, gesso, calcite, tutto impregnato in una salamoia composta principalmente da cloruri e solfati di sodio. I borati conosciuti come “duri” (tincal, colemanite e idroboracite) possiedono ganga costituita da rocce (calcite, dragonite, argilla, tobe, tufiti) e impurità di ferro.
Il tincal è un borato di sodio, solubile in acqua, proprietà che si utilizza per separarlo dalla ganga insolubile, e ottenere successivamente borace mediante cristallizzazione per raffreddamento. La colemanite è un borato di calcio con cinque molecole d’acqua nella sua struttura e l’idroboracite è un borato di calcio e magnesio con sei molecole d’acqua. Entrambi hanno come impurità principali ferro e arsenico.
Impatto del boro sull’ambiente
Né il boro né i borati sono tossici per gli esseri umani e gli animali. La DL50 per gli animali è di circa 6 g per kg di peso corporeo. Le sostanze con LD50 superiore a 2 g sono considerate non tossiche.
La dose minima letale per gli esseri umani non è stata stabilita, ma un consumo di 4 g/giorno è stato riportato senza incidenti, e le dosi cliniche di 20 g di acido borico per la terapia di cattura neutronica non hanno causato problemi.
Alcuni pesci sono sopravvissuti per 30 minuti in una soluzione satura di acido borico e possono sopravvivere più a lungo in soluzioni di borace. I borati sono più tossici per gli insetti che per i mammiferi.
Il borano e alcuni composti gassosi simili sono molto velenosi. Non è un elemento intrinsecamente velenoso, ma la sua tossicità dipende dalla struttura.
I borani (composti di boro e idrogeno) sono tossici, così come facilmente infiammabili e richiedono particolari precauzioni durante la manipolazione. Il boroidruro di sodio presenta un pericolo di incendio a causa del suo carattere riducente, e del rilascio di idrogeno a contatto con l’acido. Gli alogenuro di boro sono corrosivi.
Il boro nella salute umana
Scientificamente non è stato dimostrato che il boro sia una sostanza considerata essenziale nella dieta umana o che sia un requisito dietetico nei vertebrati e invertebrati, o almeno della stessa importanza che occupa nelle piante.
Il corpo umano contiene almeno 0,7 mg per chilo di peso di boro ottenuto dal consumo di acqua e vegetali. Un essere umano consuma nella sua assunzione giornaliera circa 0,8 a 2,5 mg di boro per chilo di peso senza manifestare alcun sintomo.
Diete forzate di 5 g al giorno possono causare nausea, diarrea e vomito; alcuni autori suggeriscono che 20 g al giorno di boro possono essere mortali in organismi sensibili, ma non è stato dimostrato.
Altre bibliografie sembrano associare la comparsa di artrite all’assunzione di questo elemento e altre pubblicazioni stimano che questo elemento debba essere considerato a livello di elemento essenziale per il metabolismo di calcio, rame, magnesio e la fissazione dell’azoto.
Il boro può essere tossico per le piante, anche a livelli bassi di concentrazione. Una concentrazione di boro inferiore a 1 mg/l è essenziale per lo sviluppo delle piante. La maggior parte delle piante mostra problemi di tossicità quando la concentrazione di boro supera i 2 mg/l.
L’Organizzazione Mondiale della Sanità raccomanda una concentrazione di boro nell’acqua potabile inferiore a 0,5 mg/l. Gli standard UE richiedono un livello di boro inferiore a 1 mg/l.
Trattamento degli effluenti con boro
Il boro, a causa della sua natura, non è facile da eliminare dalle matrici acquose. Le tecniche classiche di coagulazione, sedimentazione e anche l’osmosi inversa non sono soddisfacenti.
Alcune esperienze hanno indicato che l’applicazione di sistemi di resine a scambio ionico insieme a zeoliti e carbone attivo sono molto più promettenti come metodi per ridurre tale elemento.
Tabella dei trattamenti abituali degli effluenti con boro
| Metodo | Concentrazione iniziale boro | Efficacia | Processo | Applicazione industriale | Costi relativi |
| Precipitazione alcalina | Alta | Bassa | Discontinuo | Bassa | Molto bassi |
| Adsorbimento Me(OH)x | Alta | Molto alta | Discontinuo | Alta | Bassi |
| Adsorbimento su argilla | Alta | Molto alta | Discontinuo | Media | Bassi |
| Scambio ionico | Bassa | Molto alta | Continuo (rigenerazione) | Alta | Alti |
| Estrazione | Bassa | Alta | Continuo | Bassa | Alti |
| Osmosi inversa | Bassa | Alta | Continuo (pulizia) | Alta | Alti |
| Elettrodialisi | Bassa | Alta | Continuo | Bassa | Alti |
| Evaporazione | Alta | Alta | Continuo | Media | Alti |
Le soluzioni più utilizzate sono: Osmosi inversa, Scambio ionico e il trattamento degli effluenti con Evaporazione.
La dissalazione per osmosi inversa
La quantità di boro nell’acqua di mare varia da 4 a 5,5 mg/L, proporzionale alla salinità. Proviene principalmente dallo scarico degli impianti di trattamento delle acque reflue, dove si cominciano a utilizzare saponi e detergenti, così come dai fertilizzanti agricoli.
Il boro è presente nell’acqua come acido borico H3BO3 e borato H3BO2-. La specie di boro predominante dipende dal pH dell’acqua.
Il valore pKa di H3BO3/H3BO2- è 9,2, pertanto l’equilibrio è normalmente spostato a sinistra, dato che il valore di pH standard dell’acqua di mare è 8.
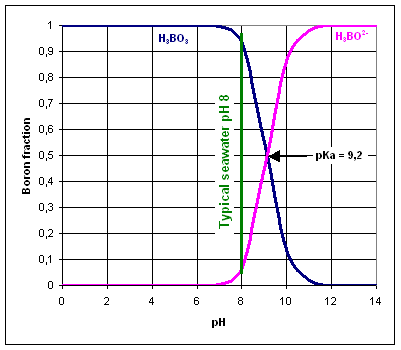
Le membrane di osmosi inversa sono molto efficienti nell’eliminazione di specie cariche come l’ione borato, invece che di molecole neutre come l’acido borico.
Le percentuali tipiche di eliminazione del boro a pH 8 sono tra il 73 e il 90% per membrane standard di osmosi inversa ad alto rifiuto per acqua di mare, a seconda della temperatura dell’acqua. Alcune membrane speciali ad alta eliminazione di boro possono raggiungere valori fino al 95%.
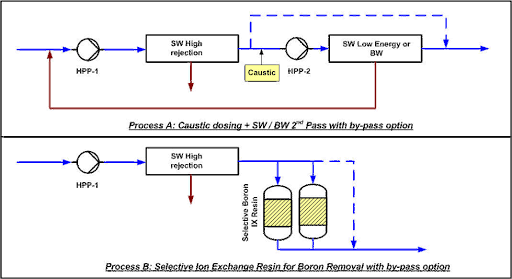
Normalmente l’acqua di mare ad alta salinità ha un alto contenuto di boro e si trova in aree con clima molto caldo, come il Golfo Persico, il Mar Rosso, il Mar Mediterraneo orientale e il Mar dei Caraibi.
A 30 °C, l’eliminazione del boro si riduce al 78%, lasciando 1,15 mg/l nella corrente di permeato del Passo-1. Pertanto, è necessario un processo specifico di eliminazione del boro per raggiungere i 0,5 mg/l richiesti dall’OMS.
Eliminazione del boro dall’acqua dissalata
Esistono due processi principali per produrre acqua potabile con meno di 0,5 mg/L di boro, a seconda della salinità dell’acqua, della concentrazione di boro e della temperatura.
Processo A: SWRO a 2 fasi:
Nel passo-2 di osmosi inversa si aggiunge soda caustica per aumentare il pH a 9,5. Parte del permeato del passo-1 può essere bypassato per mantenere una certa quantità di minerali nell’acqua. Il secondo passo può essere composto da membrane per acqua di mare a bassa energia se la temperatura e la salinità sono elevate o membrane ad alto rifiuto per acqua salmastra in caso di condizioni meno severe.
Processo B: SWRO+ IX:
Si aggiunge una resina a scambio ionico con o senza bypass, a seconda della concentrazione residua di boro necessaria. La resina, che deve essere selettiva per il cloro, si rigenera in situ con soda caustica e acido cloridrico. Per una produzione continua è necessario un sistema a doppia colonna.
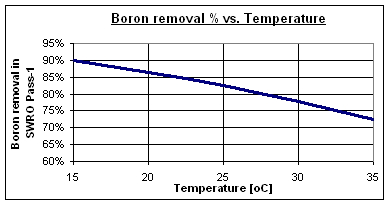
Il sistema di trattamento per l’eliminazione del boro tramite ione selettivo permette di eliminare da qualsiasi acqua l’eccesso di questo elemento, che, in determinate colture (principalmente frutticole da nocciolo o da seme), la sua alta concentrazione può diventare tossica o dannosa per la piantagione.
Questa tossicità può avere maggiore incidenza quando si utilizzano acque reflue per l’irrigazione, o acque sotterranee contaminate da queste ultime.
L’influente attraversa la resina a scambio ionico, appositamente progettata per l’eliminazione del boro in soluzioni acquose, ottenendo in uscita un’acqua con una riduzione del boro del 90%.
La capacità di scambio è limitata e quando la resina è esaurita si effettua la sua rigenerazione.
La rigenerazione delle resine è totalmente automatizzata e si effettua mediante il passaggio di una determinata concentrazione di acido attraverso il letto di resine, eliminando da queste il boro trattenuto, permettendo lo stoccaggio della soluzione acquosa di rigenerazione, in modo che possa essere gestita come rifiuto successivamente.
Gli effluenti ricchi di boro provenienti dalle resine o dalle membrane di osmosi inversa possono essere concentrati fino a valori che ne permettano il recupero, mediante tecniche di evaporazione a vuoto. Condorchem – Envitech ha la capacità di offrire soluzioni integrate per questa applicazione.
Riassunto
Il boro è un elemento chimico molto reattivo che si presenta in natura combinato in diverse forme. Ha molteplici applicazioni industriali e un futuro importante basato sull’apparizione del borofene, come successore del grafene, le cui proprietà lo rendono un candidato solido per applicazioni nanotecnologiche.
Nonostante sia necessario per la vita delle piante, e sia ben tollerato dagli esseri umani e dagli animali, esistono limiti che non devono essere superati per non risultare nocivo.
Una delle soluzioni tecniche utilizzate da molti anni per combattere la siccità è la dissalazione per osmosi inversa, ma il concentrato è ricco di questo elemento e inoltre l’acqua dissalata tende a rimanere sopra le 0,5 ppm stabilite come limite massimo dall’OMS, il che richiede trattamenti complementari che separano più boro.
Le opzioni consistono nel far passare il permeato attraverso un secondo stadio di osmosi inversa, oppure attraverso un letto di resine specifiche. Nel caso delle resine si elimina praticamente tutto il boro presente.
In entrambi i casi rimane un concentrato che potrà essere recuperato previa concentrazione in un sistema di evaporazione a vuoto, in cui Condorchem – Envitech ha esperienza comprovata.
Riferimenti bibliografici e Internet
http://oa.upm.es/155/1/05200006.pdf
https://rua.ua.es/dspace/bitstream/10045/13838/1/Tesis_Chillon.pdfçç