SEZIONI
- Introduzione
- Processi PAL e CARON
- Processo Sherrit-Gordon
- Processo di clorurazione del nichel
- Estrazione per formazione di chelati
Introduzione
Il Cobalto e il Nichel si trovano associati reciprocamente in natura in un gran numero di giacimenti. L’estrazione mineraria di questi metalli, insieme ad altri tecnologicamente associati ai progressi elettronici e specialmente nel campo delle batterie, dell’accumulo di energia e della riduzione del volume di questi elementi indispensabili nei nostri cellulari, computer, veicoli ibridi, veicoli elettrici, si sta riattivando per garantire forniture crescenti. Il prezzo internazionale del cobalto è aumentato del 127% nel 2017, quello del rame del 30%, quello del tungsteno del 27%, il prezzo del litio si è quasi raddoppiato dal 2015 e a questi indicatori è importante osservare come determinati paesi stiano prendendo posizione fisica in specifici giacimenti, come la Cina nel Katanga. I processi associati a questi trattamenti estrattivi devono evolversi e, a partire da tecnologie ottimizzate, affrontare giacimenti con leggi inferiori. Il cobalto e il nichel sono due elementi che assumono un ruolo nelle nuove tecnologie, specialmente in quelle con un legame energetico.
Il cobalto fa parte di superleghe di acciai che devono lavorare ad alta temperatura e resistere a processi di usura per fluage, magneti (Alnico, Fernico, Cunico..), smalti, rivestimenti, elettrodi, batterie, cavi strutturali per pneumatici. I minerali più importanti del cobalto sono l’esmalite CoAs2 e la cobaltite CoAsS, ma da un punto di vista tecnico le principali fonti di cobalto sono gli “speiss”. Questi materiali sono una miscela di arsenuri che contengono quantità apprezzabili di nichel, cobalto, ferro o argento. Le principali riserve di cobalto si trovano in Congo, Russia, Perù, Canada, Finlandia, Cile, Birmania, Marocco e Zimbabwe. Normalmente l’arsenico fa anche parte dei minerali costitutivi. Il trattamento iniziale di questi arsenuri avviene mediante frantumazione e concentrazione per flottazione o gravità. Le parti arricchite in nichel, cobalto e spesso anche ferro, sono miscelate con coke metallurgico. Questo coke si ottiene dal carbone bituminoso in forni con atmosfera priva di ossigeno, rimuovendo il contenuto volatile e ottenendo un carbone poroso adatto a questi trattamenti metallurgici. La miscela del minerale si effettua con ossido di calcio e silice, producendo una scoria. Questo permette di separare l’argento, una miscela di materiali ricchi in rame, nichel e cobalto e un residuo scoriabile. Questa miscela ricca in rame, nichel e cobalto è ciò che tecnicamente si chiama “speiss”. Il percorso di questa miscela fino allo stato puro del metallo è un processo complesso.
Il nichel si trova in natura normalmente combinato con arsenico, antimonio e zolfo come solfuro. Approssimativamente il 65% del nichel è utilizzato nella fabbricazione di acciaio inossidabile austenitico e un altro 21% nella fabbricazione di superleghe. Il resto è utilizzato per la fabbricazione di altre leghe (Alnico, mu-metalli, monel, nitinol) e catalizzatori. Canada, Cuba e Russia producono il 70% del nichel nel mondo. Bolivia, Colombia e Nuova Caledonia hanno anche importanti giacimenti. I minerali fonte di nichel sono la millerite, NiS, anche se ci sono depositi di NiSb, NiAs2, NiAsS o NiSbS e la garnierite Si4O13[Ni, Mg]2•2 H2O. I depositi più importanti da un punto di vista commerciale sono quelli di garnierite, che è un silicato di magnesio e nichel di composizione variabile e combinato con la pirrotina (FenSn+1) che contiene dal 3 al 5% di nichel. Si trova anche nichel proveniente da meteoriti legate con il ferro.

PROCESSI PAL E CARON
In generale il trattamento del nichel si basa sul trattamento dei solfuri di nichel mediante tostatura all’aria per ottenere NiO. Questo viene ridotto con carbone per ottenere nichel metallico. La purificazione del nichel avviene mediante monossido di carbonio che si combina con il nichel impuro a 50ºC e pressione atmosferica o con la miscela di nichel e rame, in condizioni più complesse, ottenendo Ni(CO)4, che è volatile. Per decomposizione termica a 200ºC si recupera il nichel puro con elevata purezza.
Quando si parla della metallurgia del nichel e del cobalto, si devono differenziare diversi tipi di giacimenti. In primo luogo i giacimenti lateritici limonitici. Sono terreni situati in regioni calde che si caratterizzano per bassa concentrazione di silice e alto contenuto in ossidi. Questi materiali sono abitualmente trattati con metodi idrometallurgici; processo CARON (lisciviazione generata da carbonato di ammonio) e processo PAL (lisciviazione acida ad alta pressione). Il processo metallurgico PAL implica il preriscaldamento del minerale e la lisciviazione con acido solforico concentrato ad alte temperature e pressioni. Le specie chimiche di nichel e cobalto, mediante processo chimico idrometallurgico, si trasformano in sali di solfato solubili, e si recuperano dalla soluzione in un circuito di decantazione a controcorrente (CCD). Il CCD implica il lavaggio del residuo e il recupero del nichel e del cobalto solubili. L’acido residuo viene neutralizzato usando una sospensione di carbonato di calcio, che produce un precipitato di solfato di calcio. Si può iniettare solfuro di idrogeno per precipitare nichel e altri solfuri. Da questo punto, c’è una lisciviazione successiva per eliminare ferro e rame, e infine la precipitazione del nichel mediante l’aggiunta di ammoniaca, solfato di ammonio e idrogeno. Uno dei processi più utilizzati per trattare “speiss” di nichel e cobalto è il processo Sherrit-Gordon Mines Ltd. di Fort Saskatchewan Alberta, Canada.
PROCESSO SHERRIT-GORDON
I processi della metallurgia del Nichel e del Cobalto iniziano con il trattamento iniziale del minerale, riconcentrandolo attraverso la frantumazione e la flottazione/gravità ottenendo uno “speiss”, ricco in cobalto e nichel. Il processo inizia introducendo il minerale associato fondamentalmente a solfuro, in un reattore con acido solforico e aria a pressione. In questa procedura si eliminano i solfuri ottenendo solfato di nichel (II) e solfato di cobalto (II) in soluzione. In questa prima fase di dissoluzione si elimina il solfuro.
NiS + 2O2 ⟶ NiSO4
CoS + 2O2 ⟶ CoSO4
Il processo di lisciviazione avviene con NH3, si regola il pH e si produce una prima precipitazione del ferro.
NH3 + H2O ⟶ NH4OH
Fe+3 + OH ⟶ Fe(OH)3
Si produce la precipitazione di Fe3+ in forma di Fe2O3 e di SiO2. Il ferro, abitualmente associato ai solfuri di cobalto e nichel, deve essere separato. Regolando il pH a valori vicini a 7, si produce la sua deposizione. Successivamente, nelle stesse condizioni di aria a pressione e ammoniaca, si produce l’ossidazione di Co2+ a Co3+.
Le soluzioni di cobalto (II) in soluzione acquosa e in presenza di ammoniaca si ossidano facilmente a Co (III) con formazione di complessi. La maggior parte degli agenti formatori di complessi sono ligandi che provengono da acidi deboli, cioè basi di Brönsted e pertanto il valore del pH è un fattore critico per la formazione e stabilizzazione del complesso. La concentrazione effettiva del ligando nella soluzione, determinata dal pH, influenzerà la dissoluzione del complesso. In generale, a valori di pH elevati, la dissociazione del complesso è minore, poiché a tali valori di pH predomina il ligando libero.
Tuttavia, da un lato, l’ossidazione del Co(II) a Co(III) non è facile poiché i composti di Co(II) sono molto più stabili e dall’altro i composti di coordinazione del Co(III) scambiano difficilmente i ligandi a differenza di quelli di Co(II), perciò nella chimica a goccia che richiede tempo e non si può fornire energia termica al sistema, si ottiene quasi sempre una miscela dei due complessi, quelli di Co(II) e quelli di Co(III). Per questo motivo il reattore viene portato a temperature di 80ºC e pressioni d’aria di 9 atmosfere. La spiegazione può essere fatta considerando i dati della seguente tabella;
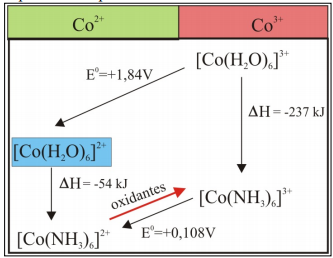
In questa parte del processo di lisciviazione è necessario l’apporto di temperatura, per la formazione del [Co(NH3)6]3+.
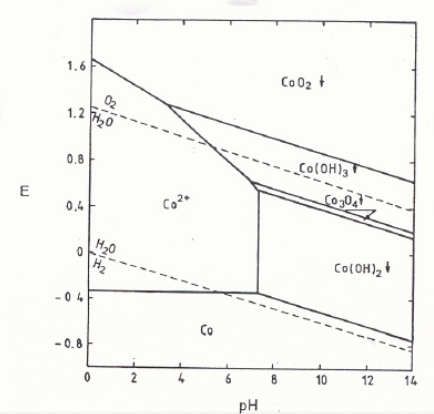
La formazione del Co3+, secondo il diagramma di Pourbaix, è favorita da pH basici e potenziali superiori a 1.2.
Nel passo successivo si aggiunge acido solforico in modo da produrre il solfato di nichel e ammonio (NiSO4 (NH4)2SO4.H2O ). Questo sale ha una colorazione verde ed è poco solubile in acqua in modo da favorire la precipitazione. In questo passo si procede ad evaporare e cristallizzare questo sale, ripetutamente per aumentare la purezza dei cristalli. Questi cristalli di solfato doppio di nichel e ammonio sono trattati con una soluzione concentrata di NaOH, in modo da ottenere Ni (OH)2. L’idrossido di nichel si dissolve con acido solforico e si ottiene solfato di nichel, che per elettrolisi permette la riduzione del Ni2+ a Ni0. Le soluzioni di solfato di ammonio permettono il recupero dell’ammoniaca per stripping.
Infine la soluzione liquida che contiene [Co (NH3)6]3+, viene ridotta da Co3+ a Co2+, mediante polveri di Co0 (cobalto metallico). Infine, mediante idrogeno si produce la riduzione del Co2+ a Co0. Ottenendo polvere di cobalto metallico.
Segue un diagramma con la sequenza delle diverse operazioni del processo Sherrit-Gordon.
PROCESSO DI CLORURAZIONE DEL NICHEL
Attualmente le grandi miniere di cobalto e nichel sono in fase di netto esaurimento e le principali miniere di questi due metalli sono costituite da leghe inferiori e concentrazioni minerali formate da diversi metalli. Questo obbliga in ogni caso a modificare i processi estrattivi di trattamento del minerale.
In questo senso, nel caso di “speiss” di cobalto e nichel a bassa lega si procede con trattamento in ambiente clorurato;
Co2+ + Cl2 + ZnO (pH4; regolatore di pH) ⟶ Co3+
Ni2++ Cl2 + ZnO (pH4; regolatore di pH) ⟶Ni3+
Controllando adeguatamente il pH e il potenziale di riduzione, specialmente a pH basico secondo il diagramma di distribuzione delle specie chimiche, il Ni(II) può mantenersi in soluzione e precipitare il Co(OH)3:
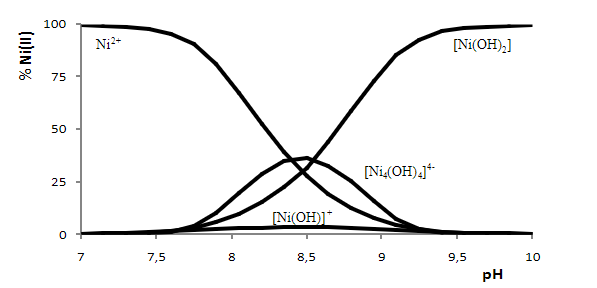
Mediante calcinazione si può trasformare l’idrossido di cobalto in ossido di cobalto. Questo ossido di cobalto (III) può essere impuro con ossido di zinco, per cui dovrà essere trattato a un pH debolmente acido e separato convenientemente dal cobalto. Infine l’idrossido di cobalto può essere trasformato per calcinazione in ossido di cobalto (III).
ESTRAZIONE PER FORMAZIONE DI CHELATI
Un altro dei metodi più utilizzati per il trattamento di miscele metalliche concentrate è il trattamento con agenti estraenti. In questo processo si tratta una soluzione concentrata per lisciviazione acida (acido solforico) in specie come nichel, rame e ferro. In primo luogo si tratta l’elevata concentrazione di acido solforico con ammina, con l’obiettivo di ridurne la concentrazione. In una seconda fase, si produce il trattamento di regolazione del pH a un valore tra 3 e 4 che facilita il precipitato di ferro. In soluzione si mantengono rame e nichel. Mediante solvente si estrae il rame. I tipi di solvente utilizzati in questo processo sono sostanze organiche come ossime, dietilditiocarbamato, butilacetati, cetossime…). Questi solventi formano chelati con la specie metallica in questione, in questo caso il rame, e permettono il passaggio alla fase organica formando un composto organometallico.
La fase acquosa si arricchisce con NaCN con l’obiettivo di facilitare la formazione di complessi del nichel nella fase acquosa e accentuare la differenza tra le due fasi, in modo che le due specie rimangano stabilizzate nelle rispettive fasi.
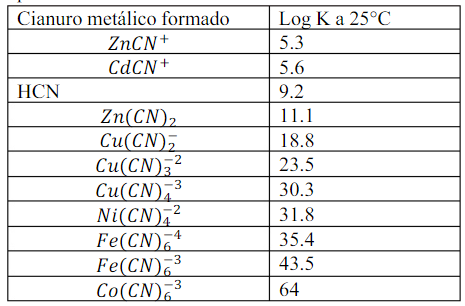
Una volta separate le soluzioni di nichel e rame, si possono recuperare i metalli per recupero elettrolitico.
BIBLIOGRAFIA
Cheng S., Gattrell M., Guenat T., MacDougall B. The electrochemical oxidation of alkaline cooper cyanide solutions. Electrochimica Acta 47 (2002) 3245-3256.
Cornwall, H. (1966). Nickel Deposits of North America. [ebook] Washington: United States Government Printing Office. Available at: https://pubs.usgs.gov/bul/1223/report.pdf [Accessed 31 July 2017].
Crundwell, F, Moats, M, Ramachandran, V, Robinson, T, & Davenport, WG 2011, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier Science, Oxford. Available from: ProQuest Ebook Central. [31 July 2017].
Kumar, V., Sahu, S. and Pandey, B. (2010). Prospects for solvent extraction processes in the Indian context for the recovery of base metals. A review.Hydrometallurgy, 103(1-4), pp.45-53.
Jeffrey M.I., Linda L.,. Breuer P.L, Chu C.K. A kinetic and electrochemical study of the ammonia cyanide process for leaching gold in solutions containing copper. Minerals Engineering 15 (2002) 1173–1180
Ones, J. (2017). Nickel Powders from the Carbonyl Process. [online] AZoM.com. Available at: https://www.azom.com/article.aspx?ArticleID=499 [Accessed 31 July 2017].