Sezioni
Introduzione
Gli elementi chimici denominati Terre Rare, o Lantanidi, si trovano nel periodo corrispondente al Lantanio. Comunemente si esprimono come ossidi di terre rare sotto la denominazione ETR o REE, Rare Earth Elements. Questo gruppo di elementi è formato da 15 elementi con proprietà chimiche molto simili ma differiscono nelle loro proprietà fisiche, circostanza che rende difficile la loro separazione.
Questa sequenza di elementi presenta, a causa della loro configurazione elettronica, la contrazione lantanidica. Questo fatto rappresenta la diminuzione graduale della dimensione dell’atomo all’aumentare del numero atomico. Il numero atomico di questi elementi varia dal n° 57 (La) al 71 (Lu) e in questo gruppo sono inclusi Sc (21) e Y (39), (Puche, Cascales, Porcher e Maestro) (Gambogi e Curier, 2010).
La configurazione elettronica di questi elementi indica che il loro stato di ossidazione più stabile è il trivalente, sebbene si possano stabilizzare gli stati +2 (Eu, Yb, Sm) e +4 (Ce, Pr, Tb). A causa della loro distribuzione elettronica presentano proprietà magnetiche e ottiche peculiari che si evidenziano, per esempio, nel caso del Neodimio (magneti di grande potenza).
Le terre rare corrispondono a 17 elementi chimici, tra cui si trovano i 15 lantanidi (lantanio, cerio, praseodimio, neodimio, prometio, samario, europio, gadolinio, terbio, disprosio, olmio, erbio, tulio, itterbio e lutezio) oltre allo scandio e ittrio, che si aggiungono a causa delle loro somiglianze fisico-chimiche con i lantanidi (principalmente la loro configurazione elettronica, potenziali di ionizzazione, carattere altamente elettropositivo e somiglianza nel loro raggio ionico (+3)), il che rende gli elementi delle terre rare altamente intercambiabili tra loro in una grande quantità di minerali (tramite una reazione di spostamento metallico).
Le terre rare si classificano in tre gruppi: terre rare leggere (LREEs: light rare earth elements), terre rare pesanti (HREEs: heavy rare earth elements) e il gruppo delle terre rare medie (MREEs: middle rare earth) che comprende dall’elemento samario al gadolinio.
Minerali di provenienza
In natura esistono circa 200 minerali che contengono nella loro composizione terre rare. Normalmente si producono associazioni in uno stesso minerale di diversi elementi a causa delle loro proprietà chimiche simili. Il Cerio è l’elemento appartenente alle terre rare che si trova in maggior proporzione nella crosta terrestre (più del rame) e il Neodimio e Lantanio sono più abbondanti del Nichel, Piombo e Cobalto.
Attualmente si utilizzano come minerale delle terre rare la Monazite [(Ce, La, Th) PO43], lo Xenotimo, [(YPO4)3] e la Loparite (Na,Ce,Sr)(Ce,Th)(Ti,Nb)2O6 come minerale di minore ricchezza, (Puche, Cascales, Porcher e Maestro).
La Monacite è un minerale del gruppo dei fosfati, di formula [(,,,ℎ)4] che corrisponde al secondo minerale più importante di LREEs con riserve in Australia, Brasile, Cina, India, Sri Lanka e Stati Uniti. I giacimenti che contengono monacite solitamente contengono torio, elemento radioattivo, per cui molti paesi lo scartano come fonte di terre rare a causa dei danni che potrebbe causare all’ambiente.
Le concentrazioni di elementi di terre rare e torio nel minerale di monacite variano a seconda del giacimento, con una media del 70% di terre rare (principalmente cerio, neodimio e lantanio) e 12% di torio (si possono anche trovare percentuali di uranio, che come il torio, è un elemento radioattivo).
La monazite è un ortofosfato di terra rara e torio (RTh)PO4. È il minerale che contiene terre rare più abbondanti, costituisce un sottoprodotto dell’ilmenite che accompagna lo zircone.
La Bastnasite è un fluorocarbonato (RFCO3) che contiene terre rare, in particolare Ce, Nd, Eu e La. Le riserve più importanti si trovano in Mongolia e in California.
Questo minerale fluorocarbonatato di formula [(,)3(,)] si trova in depositi esistenti in Cina e Stati Uniti, corrispondendo alle maggiori riserve di terre rare leggere (principalmente lantanio, cerio e neodimio) al mondo. Contengono una bassissima concentrazione di torio e il loro contenuto di elementi di terre rare è circa il 70%.
Lo Xenotimo è un ortofosfato di terre rare e triche, con elevato contenuto di cerio e torio. Il giacimento più importante di questo minerale si trova a Guandong (Cina) sebbene il suo contenuto in uranio e torio e l’attività radioattiva associata a essi limitino la sua estrazione. Altri giacimenti meno rilevanti si trovano in California (USA), Malesia e Indonesia.
L’Euxenite è un minerale di formula [(,,,,ℎ)(,,)26]. Si trova normalmente come tantaloniobato (minerali dove Ta e Nb formano il composto) di titanio, terre rare, torio e uranio. Esistono depositi in Idaho (USA), Norvegia e Madagascar.
La loparite è un niobiotitanato di terra rara localizzato nella penisola di Kola, in Russia con concentrati intorno al 32% in ossidi di terre rare, fondamentalmente cerici.
Lo Xenotimo è il principale minerale di HREEs nel mondo, specificamente di ittrio. Contiene una media del 67% di elementi di terre rare e i principali giacimenti hanno una legge di xenotimo dello 0,5-5%. Esistono giacimenti di questo minerale in California (USA), Malesia e Indonesia.
L’Allanite è un minerale di formula chimica [(,,)(22+)(//4) ∙ 27]. È un minerale del gruppo epidoto (minerale del tipo silicato di formula generale 23(4)3(,), dove A e B possono essere sostituiti da diversi elementi), è presente in 3 forme che contengono cerio, lantanio e ittrio.
Si trova in ambienti ignei, metamorfi e idrotermali. La percentuale di elementi radioattivi (torio e uranio) può variare da tracce dell’elemento fino al 3%, mentre la sua concentrazione di elementi di terre rare è in media del 5%.
A causa della presenza di elementi radioattivi e della bassa concentrazione di elementi di terre rare, non viene estratto come minerale principale nelle attività minerarie.
Infine, è importante evidenziare come serbatoio importante un determinato tipo di argille ricche di terre rare. Queste argille specifiche si originano dall’esposizione alle intemperie di rocce ignee comuni con presenza di terre rare, questo fatto può provocare la lisciviazione di queste rocce e una successiva assorbimento sulla superficie di minerali alluminosilicatici di carattere argilloso (caolinite, illite e smectite), arricchendo questi di terre rare e rendendoli economicamente estraibili.
Sebbene le concentrazioni di elementi di terre rare siano generalmente basse (0,3% in media) rispetto ai minerali descritti precedentemente, il processo di questo tipo di giacimento è di minore complessità, il che lo rende competitivo economicamente.
Questo tipo di depositi esistono nel sud della Cina e in Kazakistan. Sebbene le riserve argillose costituiscano solo il 2,9% delle riserve in Cina, rappresentano il 35% delle sue esportazioni di terre rare.
In particolare in Cina (Xungu, Longnam) si trovano riserve di oltre 10MTm espresse come RO (ossidi di terre rare). Questi giacimenti situati in Cina sono giacimenti di superficie e la loro estrazione è relativamente facile e altamente redditizia.
Gli ioni di terre rare sono adsorbiti per scambio ionico nelle reti cristallografiche delle argille. Si recuperano gli elementi di terre rare a partire dalle lisciviazioni delle argille con soluzioni saline. Il 50% delle riserve mondiali di terre rare si trova in Cina.
I procedimenti industriali in uso per il loro recupero sono diretti all’ottenimento di concentrati di ETR a partire dai minerali indicati. Con eccezione della bastnasite, molti concentrati di ETR sono ottenuti come sottoprodotto o risultato di processi siderometallurgici o pirometallurgici (Orrego, 1998; Orrego, 2000; Vega, 2000; Hedrick, 1999; Dwivedi, 1982; Harrah, 1967; Sunur et al., 1985; Alarcon, 1998; Lapido, 1994; Sundaram, 1987; Swanina e Nair, 1989; The Humphreys Investment Co, 1970).
Proprietà tecnologiche
A livello mondiale le TR sono elementi che, grazie alle loro proprietà fisiche e chimiche, hanno permesso il loro utilizzo in una serie di prodotti di ultima tecnologia. In primo luogo l’industria dei magneti permanenti sempre più determinanti nelle tecnologie mediche (tecniche di risonanza magnetica nucleare, PET), tecnologie elettroniche, tecnologie di mobilità (ferroviarie), tecnologie ibride, ecc.
Inizialmente i magneti permanenti venivano costruiti a partire da acciai, leghe metalliche a base ferritica con valori bassi di magnetizzazione remanente e campi coercitivi. Le terre rare offrono valori alti di campi coercitivi e momenti magnetici che superano i valori dei magneti ferritici.
Le terre rare hanno il loro punto debole nel paramagnetismo a temperatura ambiente. Ma questo punto è stato superato dalle leghe Sm2Co17 e specialmente le più recenti di Nd2Fe34 B, con valori di energia magnetica di 450KJ/m3. Allo stesso modo, sono state scoperte leghe GdTbFeCo di grande efficienza nell’uso di sistemi di memoria.
L’utilizzo tecnologico delle terre rare nella costruzione di materiali ottici è un altro dei campi attuali di influenza. In particolare è la costruzione di lampade tricolore in cui la luce emessa è una combinazione di tre lunghezze d’onda 450nm; Ba Mg2 O16 Al27 Eu2+/556nm;(Ce/Tb)Mg Al11 O19/610nm; Y2O3Eu3+. Questi sistemi luminiscenti riproducono la luce del sole e ottengono un’efficienza luminosa molto elevata.
Nella stessa linea, l’utilizzo delle terre rare nella tecnologia degli schermi intensificatori di RX. Classicamente si è utilizzato il wolframato di calcio (CaWO4).
Questi materiali luminiscenti hanno lo scopo di ridurre il tempo di esposizione alle radiazioni del paziente e ottenere una corretta risoluzione. Questi materiali stanno venendo sostituiti con l’obiettivo di migliorare questa efficienza. Gd2 O2 Sc Tb+, LaOBrTm+ e YTaO.
Allo stesso modo gli schermi TV, monitor di computer e schermi di cellulari riproducono la colorazione a partire da gruppi cromofori dopati con lantanidi. Il colore rosso, per esempio, è riprodotto dall’ossisolfuro di ittrio dopato con europio (Y2O3:Eu3+). Un altro campo di applicazione delle terre rare è il campo dei laser, in particolare i laser di neodimio di grande efficienza monocromatica, coerenza e direzionalità. (Sáez, Cascales, Porcher, Maestro; 2000).
Processo estrattivo
Monacite
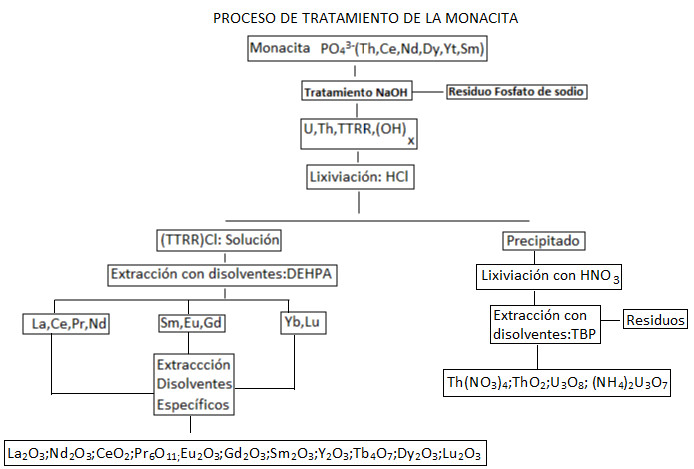
Si prenderà come riferimento uno dei minerali portatori di terre rare più importante: la monacite.
Si parte dal concentrato di monacite che viene attaccato con acido solforico a una temperatura di 200ºC, con l’obiettivo di lisciviare gli elementi lantanidi che fanno parte del concentrato.
Allo stesso modo nel processo si dissolvono impurità come uranio, torio, determinati fosfati e solfati permettendo il concentrato secondario di questo materiale radioattivo. La soluzione sarà neutralizzata lentamente.
In primo luogo si procede a un trattamento con idrossido di ammonio. A valori di pH 1 precipita il solfato di torio, nella sua forma insolubile. Insieme al solfato di torio precipita una piccola parte di terre rare. A un valore di pH 2,3 precipitano la maggior parte delle terre rare.
Infine a pH 6 precipita l’uranio, in forma di idrossiuranato. I precipitati corrispondenti ai valori di pH 1 e pH 6 sono trattati con fosfato di tributile con l’obiettivo di separare l’uranio dalle terre rare e migliorare il rendimento del processo. A questo punto si ottiene un concentrato di terre rare.
Aggiungendo solfato di sodio si produce il precipitato delle terre rare leggere (REE), ottenendosi;
2(4)3 ∙ 24 ∙ 2
L’ittrio, le terre rare pesanti e gli elementi radioattivi rimangono in soluzione. Il precipitato, una volta separato, è trattato con idrossido di sodio formando un concentrato di terre rare. Questo viene essiccato a 120ºC.
Il precipitato si ridissolve in acido nitrico e si precipitano selettivamente il torio e cerio aggiungendo l’idrossido di ammonio a un pH di 2,8.
Successivamente e rimosso questo primo precipitato si continua ad aggiungere idrossido di ammonio, precipitando il resto delle terre rare come idrossidi. Gli elementi di terre rare pesanti in soluzione possono essere separati da altri elementi radioattivi e concentrati, utilizzando un estrattore come il fosfato di tributile.
Per recuperare il torio e le terre rare dalla soluzione si procede a trattare la soluzione acida con ossalato di sodio precipitando il torio e le terre rare a pH 1,5, rimanendo l’uranio in soluzione. Si tratta il precipitato di ossalato con idrossido di sodio precipitando le terre rare.
Questo precipitato si calcina e si tratta con acido nitrico con l’obiettivo di ridissolvere e purificare l’estrazione delle terre rare. Questa soluzione acida si tratta con fosfato di tributile ottenendo un estratto organico con torio e cerio e una soluzione con terre rare.
L’estratto è sottoposto a una fase di depurazione con nitrito di sodio, ottenendo nitrato di cerio nella fase acquosa e nitrato di torio nella fase organica.
Argille
Il maggior volume di terre rare estratto proviene dai giacimenti argillosi della Cina. La ricchezza in terre rare non è elevata ma la facilità di estrazione favorisce la sua sfruttamento. Questa facilità si basa sulla forma ionica con cui interagiscono gli ioni lantanidi con la struttura silicatica dell’argilla.
Le terre rare si trovano in forma cationica (+3), facilmente estraibile. Il processo di estrazione si basa sull’utilizzo di soluzioni concentrate di cationi monovalenti (Na2SO4; (NH4)2SO4; NaCl; NH4Cl).
Nell’interazione si produce uno scambio ionico tra gli ioni monovalenti e gli ioni lantanidi. Le terre rare passano in soluzione in forma di solfato e/o cloruri.
Questa soluzione è trattata con ossalato di sodio in modo che si formino gli ossalati insolubili dei lantanidi, precipitando in soluzione. Questo precipitato di ossalato è calcinato a 900ºC per ottenere gli ossidi. Questo concentrato di ossidi recupera tra l’80-90% delle terre rare presenti nell’argilla originale.
In Madagascar si utilizza l’acqua di mare per lisciviare le argille e successivamente precipitare le terre rare con ossalati.
Processi di separazione e purificazione
L’utilizzo tecnologico di questi materiali richiede un alto grado di purezza nella loro ottenimento. Questo ha portato a sviluppare nuovi sistemi estrattivi più efficaci di quelli tradizionali.
Le terre rare possono essere lisciviate mediante nitrati, cloruri e solfati. Una volta ottenuto un concentrato di terre rare, si deve iniziare un processo di separazione e purificazione.
Ossidazione selettiva
In primo luogo si può effettuare un’ossidazione selettiva ossidando il cerio, praseodimio e terbio da uno stato (+3) a uno stato (+4). Nel caso del praseodimio se si produce l’ossidazione sotto una pressione alta di ossigeno può avvicinarsi alla composizione PrO2.
Il praseodimio e il terbio non sono stabili in soluzione acquosa ossidandoli al loro stato tetravalente, per cui è relativamente facile precipitarli da una soluzione di idrossidi di elementi di terre rare (si forma sciogliendo la miscela di ossidi con una soluzione di idrossido di potassio), utilizzando clorato di potassio (KClO3) come agente ossidante.
Il cerio è l’elemento di terre rare più abbondante e, pertanto, il meno prezioso commercialmente. Può essere ossidato al suo stato tetravalente riscaldando la miscela di ossidi a 650 ºC in aria, o essiccando idrossidi di elementi di terre rare in aria a 120-130 ºC.
Nelle soluzioni acquose dove gli elementi sono disciolti come idrossidi, si può ossidare il cerio mediante clorazione o elettrolisi. Si può anche ossidare il cerio in soluzione iniettando ozono come agente ossidante. Per recuperare il cerio ossidato (stato tetravalente), si può dissolvere selettivamente la miscela di elementi di terre rare in acido diluito dove l’ossido di cerio (IV) ha bassa solubilità.
L’ossido nero si dissolve in acido con liberazione di ossigeno per dare soluzioni verdi o sali verdi che hanno applicazione nell’industria della ceramica.
Gli elementi come samario, europio e itterbio sono meno abbondanti del cesio per questo motivo devono essere concentrati prima di trattarli chimicamente per la loro ottenimento. L’europio (III) può essere ridotto a europio (II) mediante catodo di mercurio. L’ottenimento del samario può essere realizzato a partire da amalgami di litio.
Metodo di estrazione supercritica
Si possono ottenere i carbonati di lantanio, neodimio, samario, europio, gadolinio, disprosio e olmio da un estratto di terre rare a partire dal trattamento di una sospensione acquosa degli ossidi con CO2 a una temperatura uguale o superiore a 31ºC e a una pressione di 71,2 atm.
In queste condizioni i carbonati Pr (III), Er(III), Yb(III) e Tb(III) non si formano o lo fanno con un rendimento molto basso. Questa tecnica di separazione è stata utilizzata anche nella separazione dei lantanidi di stato di ossidazione (III) da quelli corrispondenti allo stato (IV).
Le condizioni operative sono di 40ºC e 100 atm formando dopo un’ora di reazione i carbonati di lantanio, neodimio, samario, europio, olmio, prometio e tulio in stato di ossidazione (III). In questo modo si ottiene un precipitato carbonatato, suscettibile di essere separato e trattato con acido cloridrico. Questa soluzione può essere trattata con solventi o resine a scambio ionico.
Estrazione con solventi
Si parte da un concentrato di terre rare proveniente dalla fase di lisciviazione e si procede ad alimentare la fase di estrazione con solventi. In questa fase si separano le terre rare pesanti (terbio, disprosio, olmio, erbio, tulio, itterbio, lutezio e ittrio), medie (samario, europio e gadolinio) e leggere (lantanio, cerio, praseodimio e neodimio).
Successivamente mediante l’estrazione con solventi specifici si andranno separando ciascuno degli ossidi di terre rare specifici. Infine le purificazioni saranno effettuate con tecniche di scambio ionico o tecniche cromatografiche. I principali agenti estrattivi nel campo delle terre rare sono;
- Acidi carbossilici. Sono acidi accessibili a prezzo moderato, nonostante l’inconveniente della loro solubilità in acqua. Tra gli acidi carbossilici più usati si trovano l’acido versatico 10, acidi naftenici e l’acido 2-bromodecanoico, tutti diluiti in xilene. L’acido naftenico varia la sua solubilità in funzione del pH. A un pH di 4 la solubilità è di 0,09 g/l e varia fino a 0,9 g/l a pH 6,5. La solubilità dell’acido versatico varia tra 0,7 g/l e 0,25 g/l. L’acido 2-bromodecanoico lavora a valori più acidi. L’effetto sterico della molecola dell’acido influenza l’estrazione dei lantanidi ed è correlato al numero atomico dell’elemento metallico.
- Acidi alchilfosforici. L’acido più usato è il DEHPA (acido di-2-etilesilfosforico). Questo acido si utilizza diluito in cherosene. Per esempio, HCl 0,1M mediante una soluzione di DEHPA 0,2M in cherosene. Si osserva che l’estrazione di questi elementi migliora nell’ordine La < Ce < Nd < Sm < Eu < Gd < Tb < Dy = Y < Ho < Er < Tm < Yb < Lu, diminuendo il valore del coefficiente di distribuzione con l’aumento della temperatura. Un altro tipo di acido alchilfosforico impiegato è l’EHEHPA (acido 2-etilesil-2 etilesilfosforico), anch’esso diluito in cherosene. Una formulazione utilizzata è quella di HCl 0,1M e la concentrazione dell’agente di estrazione in cherosene 0,2M. In questo sistema, l’estrazione del metallo aumenta con il numero atomico anche se è minore se confrontata con il sistema del DEHPA. L’utilizzo degli acidi fosfonici e/o acidi fosfinici migliora la separazione tra lantanidi contigui.
- Idrossiossime. In particolare agenti acidi con la capacità di formare chelati. Questi estrattori sono stati abitualmente utilizzati nel trattamento del Cu, ma sempre più si espande la loro utilità nel trattamento delle terre rare. Per esempio, è stato impiegato il SME 529 (attualmente LIX 84) per studiare l’equilibrio di estrazione del Ce(III) e La(III) in un mezzo cloruro di sodio, diluendo l’agente di estrazione in n-eptano. È stato anche impiegato il LIX 70 per l’estrazione di queste due terre rare (25). In questo caso, come diluenti della fase organica sono stati testati il cherosene e l’n-eptano, essendo il mezzo acquoso NaCl. Sia il cerio che il lantanio si estraggono quantitativamente, anche se il cerio può essere estratto a valori di pH più bassi.
Il tipo di ammina e il mezzo acquoso influenzano decisamente l’estrazione di questi elementi. Le ammine primarie (RNH2) estraggono questi metalli da un mezzo solfato, mentre le ammine terziarie (R3N) li estraggono da un mezzo nitrato.
In generale, le terre rare leggere si estraggono preferibilmente con questi agenti di estrazione basici.
- TBP (fosfato di tributile) e DBBP (di-n-butil-n-butil-fosfonato). Si estraggono le terre rare da diversi mezzi acquosi. Con essi si ottengono europio e samario. Il loro modo di azione si basa sulla reazione: Ln3+aq + 3NO- + 3Lorg < => Ln(NO3)3L3(org)
- Eteri Corona. Sono stati utilizzati per l’estrazione di lantanidi. Il (sim-dibenzo-16corona-5-acido ossiacetico) in soluzione 80:20 cloroformio – eptanolo.
Nel caso degli eteri corona l’estrazione delle diverse terre rare dipende molto specificamente dal pH corrispondente al mezzo acquoso e, così, il Lu3+ si estrae quantitativamente a un pH di 6,7, mentre il La3+, Pr3+, Sm3+, Eu3+, Tb3+, Er3+ e Yb3+ lo fanno quasi quantitativamente (> 98 %) a un pH di 6,5. La stechiometria del complesso estratto è 1:2 (metallo: agente di estrazione). I calixarenes sono (1,n)-ciclofani che presentano una cavità formata da gruppi fenilici che agiscono come ponti, permettendo, inoltre, l’introduzione di sostituenti nello scheletro organico. Questa struttura ha fatto sì che questi composti siano stati studiati come reagenti per l’estrazione di alcuni lantanidi trivalenti (lantanio, neodimio, europio, erbio e itterbio). - Miscele sinergiche. Le miscele sinergiche stanno sostituendo i sistemi tradizionali di estrazione con un solo estrattore. Le miscele sinergiche, cioè la combinazione di due o più agenti estrattivi che aumentano l’efficacia dell’estrazione e potenziano la specificità dell’operazione di separazione, assumono particolare importanza. Per esempio è stato studiato un acido fosfonico come il PC-88 A (acido 2-etilesilfosfonico) disciolto in n-eptano insieme al DTPA (dietilammina-acido pentaacetico) per l’estrazione di lantanidi.
I fattori di separazione tra Y/Ho/Er sono maggiori aggiungendo DTPA, mentre la stechiometria della specie estratta si rappresenta con LnR3-3HR.
Conclusioni
Le terre rare erano qualche anno fa semplicemente la parte finale della tavola periodica a cui non si arrivava per mancanza di tempo o semplicemente per ignoranza. Oggi, le loro proprietà tecnologiche e le loro applicazioni industriali hanno collocato questi minerali nello status di minerali critici per molti governi.
Nell’Ordine Presidenziale Esecutivo 13817, del 20 dicembre 2017, del Governo degli Stati Uniti si riconosce la vulnerabilità che rappresenta per un sistema tecnologico la dipendenza esterna da 35 minerali classificati come minerali critici, 17 dei quali sono terre rare.
Si caratterizzano per avere un’alta conducibilità elettrica e proprietà magnetiche che le rendono ottimali per fabbricare batterie, telefoni cellulari, batterie per veicoli elettrici, sistemi di illuminazione led, aerogeneratori, sistemi laser, tecnologie per satelliti, sistemi di difesa, ecc.
Queste applicazioni richiedono purezza nei metalli ottenuti e trattamenti efficaci dei concentrati. Nuovi metodi come l’applicazione degli eteri corona, l’utilizzo delle miscele sinergiche come le combinazioni degli acidi alchilfosforici, o l’applicazione dei sali di ammonio quaternari faciliteranno l’ottimizzazione del processo di arricchimento.
Bibliografia
F.J.Alguacil e F.Rodríguez, CSIC. Processo di separazione delle terre rare. Rev. Metal Madrid, 33 (3), 1997
Bautista, R.G. Mineral Proc. Extractive Met. Rev., 8, 1992: 175-182.
Bautista, R.G. e Jackson, N. Rare Earths, Resources, Science, Technology and Applications. TMS. Warrendale (USA), 1992.
Habashi, F. Rare Earths’90. Proc. Int. Symp. on Processing of Rare Metals. Osaka (Giappone), 1990: 47-52.
Patricio Javier Avendaño Corvalán, Tesi “EVALUACIÓN DE FACTIBILIDAD TÉCNICOAMBIENTAL DE UNA PLANTA DE EXTRACCIÓN DE TIERRAS RARAS EN CHILE” Facoltà del Cile, 2017
R.Sáez Puche, C.Cascales, P.Porcher, P.Maestro. ”Terre rare: Materiali Avanzati”. Facoltà Scienze Chimiche Università Complutense Madrid. CSIC.CNRS. Ricerca Chimica. 2000