Sezioni
- Caratteristiche di base del litio
- Applicazioni del litio
- Riciclaggio di dispositivi elettronici con batterie al litio
- Estrazione e ottenimento del litio
- Riciclaggio di batterie e recupero del litio
- Conclusioni
Caratteristiche di base del litio
Il litio (Li) è il metallo più leggero, la sua densità è la metà di quella dell’acqua. Come gli altri metalli alcalini è monovalente e molto reattivo, anche se meno del sodio, per cui non si trova libero in natura.
È un elemento moderatamente abbondante; è presente nella crosta terrestre a 65 ppm, il che lo colloca al di sotto di Ni, Cu e W e al di sopra di Cr e Sn.
Il Li, insieme a H e He, è uno dei pochi elementi ottenuti nel Big Bang. Tutti gli altri si sono sintetizzati attraverso fusioni nucleari nelle stelle della sequenza principale o durante esplosioni di supernove. Ha le seguenti caratteristiche fisico-chimiche di base:
- Densità : 535 Kg/m 3
- Durezza Mohs : 0,6
- Aspetto : Solido bianco argentato, grigio
- Massa atomica : 6,941
- Raggio atomico : 167 pm
- Stato di ossidazione : Base forte
- Struttura cristallina : Cubica a corpo centrato
- Punto di fusione : 453,69 K
- Punto di ebollizione : 1615 K
- Calore specifico : 3582J/(Kg.K)
Applicazioni del litio
Il litio è conosciuto come il petrolio bianco per il ruolo protagonista che svolge e presumibilmente svolgerà nel panorama energetico nei prossimi anni.
Le sue proprietà rendono gli ioni di litio gli ingredienti perfetti per la fabbricazione di batterie. Per il suo elevato calore specifico, viene impiegato in applicazioni di trasferimento di calore, e per il suo elevato potenziale elettrochimico costituisce un anodo adatto per le batterie di auto elettriche, smartphone e alcuni apparecchi elettronici.
Gli vengono inoltre attribuiti i seguenti usi, anche se il suo consumo è relativamente piccolo rispetto a quello già menzionato delle batterie:
- I sali di litio, in particolare il carbonato di litio (Li2CO3) e il citrato di litio, sono impiegati nel trattamento della mania e della depressione bipolare, anche se ultimamente il loro uso si è esteso alla depressione unipolare. È uno stabilizzatore dell’umore. Si pensa che i suoi effetti si basino sulle sue azioni attive sulla funzione della serotonina. Inoltre, si trova disciolto nel plasma sanguigno e/o negli eritrociti.
- Il cloruro e il bromuro di litio hanno un’elevata igroscopicità, per cui sono eccellenti essiccanti. Il secondo è impiegato in pompe di calore ad assorbimento, tra altri composti come il nitrato di litio.
- Lo stearato di litio è un lubrificante generale in applicazioni ad alta temperatura.
- Il litio è un agente impiegato nella sintesi di composti organici.
- L’idrossido di litio è usato nelle navicelle spaziali e nei sottomarini per purificare l’aria estraendo l’anidride carbonica.
- È componente comune delle leghe di alluminio, cadmio, rame e manganese impiegate nella costruzione aeronautica, ed è stato usato con successo nella fabbricazione di ceramiche e lenti, come quella del telescopio di 5,08 m di diametro del Monte Palomar.
- Ha anche applicazioni nucleari. Gli isotopi stabili del litio sono due: Li-6 e Li-7, quest’ultimo il più abbondante (92,5%).
Annualmentente entrano nei mercati dell’Unione Europea 800.000 tonnellate di batterie per automobili, 190.000 tonnellate di batterie per uso industriale e 160.000 tonnellate di batterie per consumo domestico o cittadino. Nella loro composizione, queste batterie contengono litio e altri metalli preziosi come cobalto, rame, ecc.
A livello mondiale, si stima che il mercato delle batterie agli ioni di litio genererà ricavi per 46.210 milioni di dollari nel 2022. A causa della crescente tensione tra offerta e domanda sul mercato, i prezzi del litio sono aumentati del 47% nel 2016, e si stima che la domanda aumenterà del 64% entro il 2020.
Il problema riguarda gli effetti ambientali dello sfruttamento di questo minerale, come l’inquinamento delle acque, impatti sul paesaggio, impatto sulla flora e fauna, generazione di rifiuti solidi e chimici… L’Argentina è molto consapevole di queste questioni, poiché le autorità hanno confermato che il paese triplicherà la produzione di litio entro il 2019. Si prevede che entro il 2025 la produzione di litio si collocherà tra 400.000 e 500.000 tonnellate.
Riciclaggio di dispositivi elettronici con batterie al litio
Il trattamento e riciclaggio dei rifiuti provenienti da apparecchi elettrici ed elettronici, come computer, televisori, frigoriferi e telefoni cellulari, è oggi più importante che mai per il rapido aumento del consumo di questi prodotti.
Nel riciclaggio delle batterie al Li, si scarta il litio stesso che contengono. Questo può sembrare una contraddizione, ma economicamente non lo è, poiché il prezzo del litio è sufficientemente basso da non incentivare molte iniziative private a sviluppare processi efficienti per il suo riciclaggio.
Attualmente, quando inviamo le nostre batterie al litio al riciclaggio, i metalli estratti sono quelli più preziosi, come il cobalto. Il cobalto è utilizzato nelle batterie agli ioni di litio, da cui viene poi estratto sotto forma di ossido di cobalto e litio, con un prezzo di 19 euro al chilo, più di tre volte il prezzo di mercato del litio.
Così, il recupero del litio presente nelle batterie a fine vita rappresenta un’opportunità con grande potenziale, anche se ancora con ostacoli da superare. Il riciclaggio permette di recuperare risorse preziose e ridurre la necessità di estrarle dai giacimenti, ma i processi attuali spesso implicano costi elevati e un’efficienza limitata nell’ottenimento di certi metalli, compromettendo la loro redditività. Tuttavia, il boom della mobilità elettrica e la transizione verso fonti di energia più pulite stanno accelerando l’innovazione nei metodi di riciclaggio che cercano di essere più efficaci e competitivi dal punto di vista economico.
Estrazione e ottenimento del litio
Estrazione da minerali
Esistono diversi procedimenti di estrazione. L’Australia, il maggior produttore globale, lo ottiene tramite estrazione mineraria convenzionale da minerali come lo spodumene di Greenbush, ma è un processo costoso e sporco.
Cile, Argentina e Cina, invece, utilizzano un lento processo di evaporazione dell’acqua delle saline. Si estrae da salamoie dove è presente in sali naturali come nel Salar de Atacama in Cile o nel Salar del Hombre Muerto e altri in Argentina, o da depositi.
Gran parte della produzione mondiale di litio proviene da queste salamoie, il cui costo di produzione è molto inferiore a quello dei depositi minerali (secondo John McNulty: 1.500-2300 $/Tm e 4.200-4.500 $/Tm, rispettivamente).
Le riserve o le risorse di litio della Bolivia sono in salamoie, che hanno una densità approssimativa di 1.200 grammi per litro (g/l), per cui una concentrazione di litio dello 0,1% in peso equivale a 1.000 parti per milione (ppm) e 1,2 g/l.
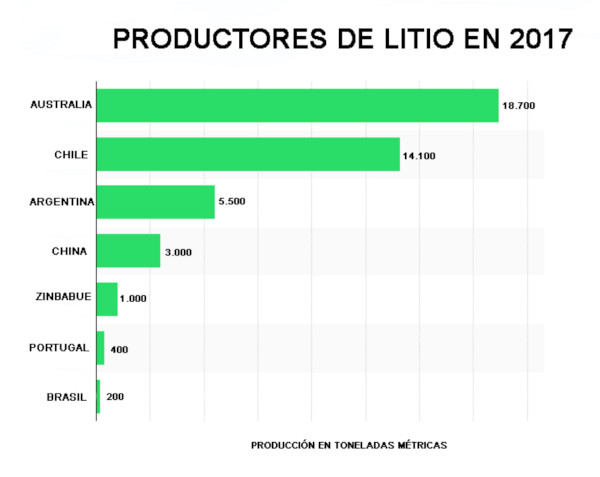
L’estrazione delle salamoie di litio si realizza mediante pompaggio e la sua concentrazione tramite adsorbimento utilizzando un adsorbente selettivo, o per evaporazione in piscine poco profonde costruite a tale scopo. L’evaporazione, oltre ad aumentare la concentrazione dei sali, fa sì che saturandosi alcuni di essi precipitino.
L’adsorbimento ha il vantaggio di non essere influenzato dalla composizione dell’acqua salata (si possono trattare salamoie con basse concentrazioni di litio come sperimentalmente si fa con l’acqua di mare), né dalle condizioni meteorologiche del luogo e non genera molti rifiuti; gli svantaggi sono che sono necessari reagenti, l’attrezzatura per l’adsorbimento è costosa e complicata e il costo dell’adsorbente è elevato.
I vantaggi dell’evaporazione naturale sono fondamentalmente che non si consuma energia né si utilizzano molti reagenti chimici, mentre gli svantaggi sono la necessità di usare simultaneamente un altro metodo di separazione, l’accumulo di rifiuti e la dipendenza dalle condizioni meteorologiche del luogo (velocità di evaporazione e piogge).
La maggiore produzione mondiale di litio da salamoie si ottiene dal Salar de Atacama in Cile, dove si utilizza il metodo di evaporazione e di cui si hanno dati e molti fattori operativi, che permettono il confronto con quelli del Salar de Uyuni in Bolivia.
Le salamoie di Atacama sono più ricche di litio rispetto a quelle di Uyuni (anche di potassio e boro), per cui il rapporto Mg/Li, nocivo per la concentrazione del litio, è di 6/1 e 19/1 rispettivamente.
Mentre l’evaporazione e la piovosità sono di 3.200 mm/anno e 10-15 mm/anno ad Atacama, a Uyuni sono di 1.500 mm/anno e 200-500 mm/anno, cioè a Uyuni l’evaporazione è minore e la pioggia molto maggiore, il che rallenterà notevolmente l’evaporazione.
Ad Atacama il processo di evaporazione che concentra il litio dallo 0,15% al 6% (40 volte) dura da 12 a 18 mesi; si prevede che a Uyuni questo processo duri molto di più.
Lo studio di laboratorio “Trattamento chimico delle salamoie del Salar de Uyuni-Potosí” realizzato nel 1987 in Francia tramite il Convenio UMSA-ORSTOM (Istituto francese di ricerca scientifica per lo sviluppo), simulando in 5 vasi le condizioni delle piscine di evaporazione, stabilì che precipita prima il cloruro di sodio (NaCl) e quasi subito dopo il cloruro di potassio (KCl).
Poiché il cloruro di magnesio (MgCl2) non può essere separato con l’evaporazione, complicando il processo, viene precipitato come idrossido di magnesio (Mg(OH)2) aggiungendo calce.
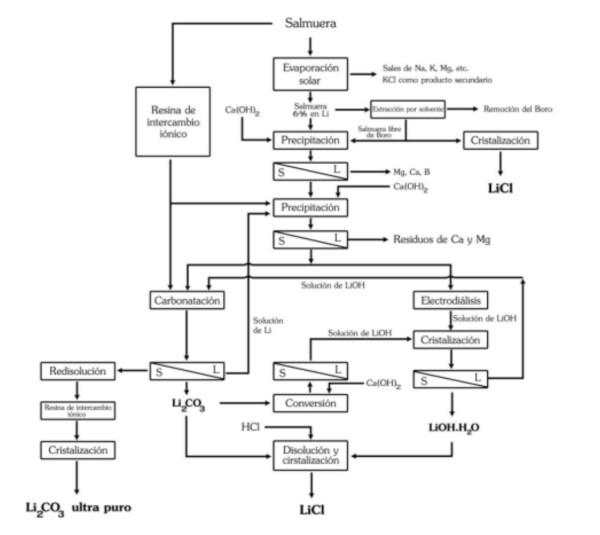
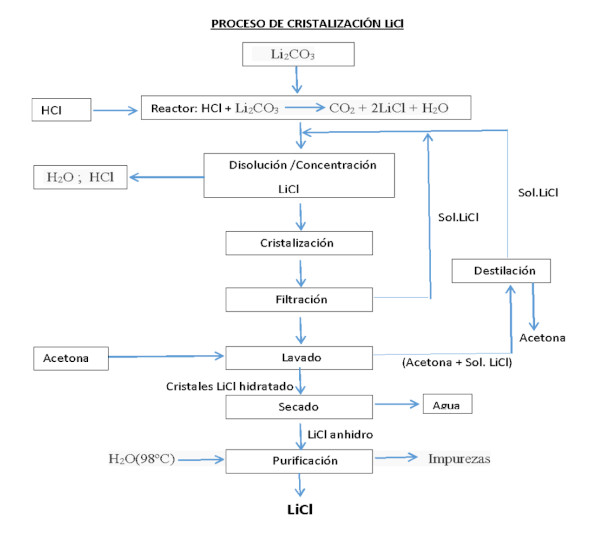
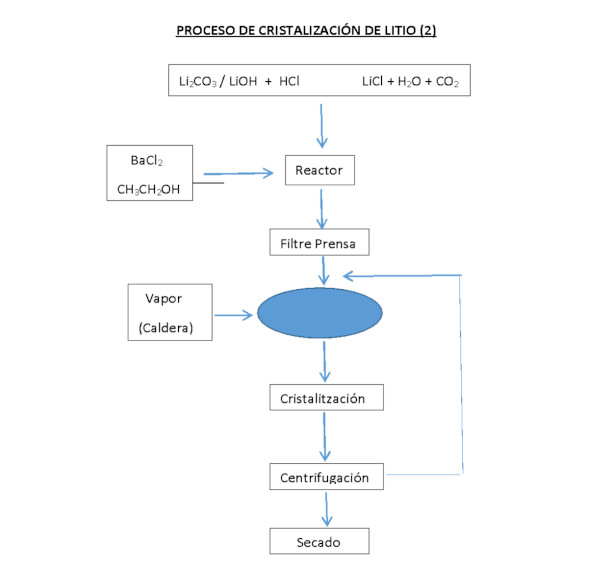
Il processo di ottenimento del cloruro di litio, a partire dal carbonato o dall’idrossido di litio, può essere realizzato reagendo con acido cloridrico:
Li2CO3 + 2HCl === 2LiCl + H20 + CO2
LiOH·H2O + HCl === LiCl + 2H2O
Precipitazione e raffinazione del carbonato di litio (CL)
Il CL ottenuto con qualsiasi metodo deve essere purificato, essiccato e cristallizzato. Nonostante l’alto contenuto di litio nel Salar de Atacama e l’esperienza nella sua estrazione, si indica che il suo recupero è del 42%.
Il CL da utilizzare nella fabbricazione di batterie per veicoli elettrici deve avere una purezza di almeno il 99,95%, per cui il CL ottenuto per precipitazione deve essere raffinato attraverso varie reazioni e fasi di ricristallizzazione, in alcuni casi mediante una resina a scambio ionico.
Poiché il processo di raffinazione ha un costo elevato e il recupero è minore dopo ogni fase (nella fase di raffinazione si stima circa il 70%), maggiore è la purezza del CL, più il suo prezzo aumenta in proporzione molto maggiore.
Riciclaggio di batterie e recupero del litio
Consapevoli della necessità di riciclare il litio delle batterie usate e pensando alla sua futura scarsità e al crescente aumento di prezzo, sono stati studiati alcuni processi che riassumiamo di seguito:
Processo Fisico – Chimico
Il recupero dei materiali che compongono le batterie agli ioni di litio si realizza mediante il processo di Lisciviazione. Cioè, attraverso l’uso di acidi per dissolvere i componenti delle batterie una volta smontato il dispositivo.
Il processo nella sua totalità deve seguire una serie di passaggi, iniziando dalla raccolta delle batterie, classificazione e scarica dell’elettricità. Poi, si realizza la separazione dei componenti, fino a ottenere l’anodo e il catodo (parti che permettono la reazione elettrochimica) completamente separati.
In questo modo si lavora ogni parte separatamente per recuperare le materie prime della batteria.
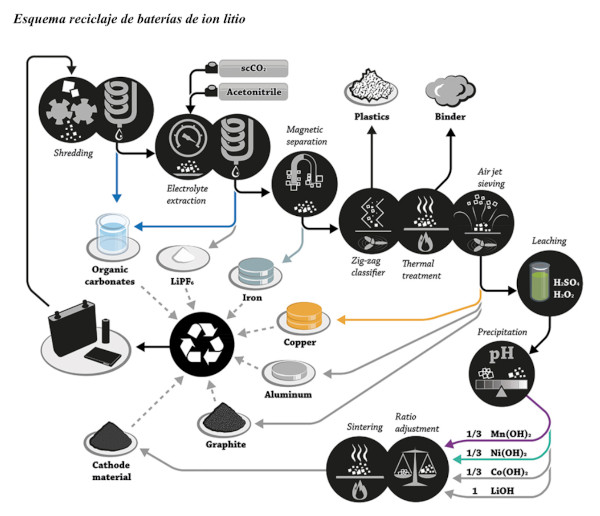
Un altro sistema presenta un’alternativa per il recupero di litio, cobalto, manganese e nichel dalle batterie usate di telefoni cellulari e computer.
Il processo inizia con lo smontaggio manuale per separare il rifiuto di interesse, poi si realizza una riduzione delle dimensioni fino a raggiungere tra 560 e 800 μm nel residuo degli apparecchi, rispettivamente.
L’alluminio e il rame sono lisciviati con idrossido di ammonio per eliminare reazioni di interferenza nelle fasi successive. Il lavaggio filtrato proveniente dalla fase precedente viene lisciviato con acido solforico, ottenendo recuperi massimi del 96,0 e 99,9 % di litio, cobalto, manganese, nichel, con concentrazioni di 3,0 e 4,0 M, in ogni tipo di residuo.
Il liquido acido lisciviato viene neutralizzato con idrossido di sodio, si aggiunge bicarbonato di sodio e si precipita carbonato di manganese, idrossido di cobalto e bicarbonato di litio, con le rispettive condizioni necessarie.
Poi si procede all’Evapo-cristallizzazione dei prodotti precipitati e si raggiungono recuperi superiori al 96,0 %, per ogni metallo.
Il Carbonato di Litio (Li2CO3) è il composto di litio più utilizzato; un grammo di litio equivale a 5,32 grammi di carbonato di litio (CL).
Recupero elettrochimico del litio
Recentemente, il ricercatore argentino Ernesto Calvo propone di implementare una tecnologia innovativa di estrazione del litio su larga scala, senza generare rifiuti inquinanti.
Per questo, estrae la salamoia mediante un sistema di pompaggio per introdurla in un reattore con due elettrodi. Questi catturano selettivamente, da un lato, gli ioni di litio, e dall’altro, il cloruro della salamoia, per essere restituito al salar.
Successivamente, si inverte la polarità elettrica del reattore e si fa il processo inverso, cioè si estrae la salamoia e si incorpora una soluzione di recupero che concentra il cloruro di litio.
Per questo processo si utilizza energia solare e il cloruro di litio estratto dalla salamoia forma una specie di batteria al litio per immagazzinare energia rinnovabile intermittente.
Membrane di Osmosi Inversa capaci di separare il litio
Recentemente è stata sviluppata una nuova tecnologia che permetterà di estrarre litio dall’acqua di mare, e inoltre di farlo in modo efficiente, producendo anche acqua potabile nel processo.
Come sappiamo, l’acqua di mare è un cocktail complesso di minerali utili, ma è difficile separare quelli di cui abbiamo bisogno, come il litio. Un team di scienziati australiani e statunitensi ha sviluppato una nuova tecnica di desalinizzazione dell’acqua che non solo può rendere potabile l’acqua di mare, ma recupera il litio presente in essa.
La chiave del processo sono le strutture metallo-organiche (MOF), che hanno la maggiore area di superficie interna di qualsiasi materiale conosciuto. Un solo grammo teoricamente potrebbe coprire un campo da calcio, ed è questa intricata struttura interna che le rende perfette per catturare, immagazzinare e rilasciare molecole.
Attualmente, le membrane di osmosi inversa sono la tecnologia più utilizzata per la filtrazione dell’acqua, e funzionano in modo abbastanza semplice. I pori della membrana sono abbastanza grandi da far passare le molecole d’acqua, ma troppo piccoli per la maggior parte degli inquinanti.
Il problema è che, per funzionare, questi sistemi richiedono di pompare l’acqua a una pressione relativamente alta.
Le membrane MOF, invece, possono essere più selettive ed efficienti.
Ricercatori dell’Università di Monash, dell’Organizzazione di Ricerca Scientifica e Industriale del Commonwealth e dell’Università del Texas, hanno sviluppato una membrana di questo tipo.
Il design si è ispirato alla «selettività ionica» delle membrane cellulari biologiche, che permette al materiale MOF di disidratare ioni specifici mentre passano. Ancora meglio, questi filtri non richiedono la formazione di acqua, il che consente anche un risparmio energetico.
«Possiamo usare le nostre scoperte per affrontare le sfide della desalinizzazione dell’acqua», dice Huanting Wang, autore del nuovo studio. Invece di affidarsi ai processi costosi e ad alto consumo energetico attuali, questa ricerca apre la porta per rimuovere gli ioni di sale dall’acqua in modo molto più efficiente in termini di energia e ambientalmente sostenibile.
Questi ioni di litio sono abbondanti nell’acqua di mare (circa 0,17 ppm), per cui lo sviluppo di questa tecnologia potrebbe avere grandi ripercussioni per l’industria mineraria che attualmente utilizza trattamenti chimici poco efficienti per estrarre il litio da rocce e salamoie.
La domanda globale di litio richiesta per settori come l’auto elettrica è sempre più alta, per cui queste membrane si posizionano come un’alternativa efficiente per estrarre il litio stesso dall’acqua di mare, che è una risorsa abbondante e di facile accesso, per cui il suo sfruttamento dovrebbe essere anche economico.
In questa applicazione possiamo pensare a un’osmosi inversa di tipo chiuso al fine di massimizzare la concentrazione del litio e così ridurre la dimensione e il costo del successivo sistema di Evapo-Cristallizzazione necessario.
Recupero selettivo evaporativo del litio (LiOH)
Il recupero selettivo del litio da salamoie con un contenuto inferiore all’1% in presenza di alte concentrazioni di altri ioni alcalini e alcalino-terrosi è un obiettivo industriale.
I processi evaporativi si basano sulla solubilità differenziale dei sali di litio in soluzioni concentrate delle salamoie, cioè ricristallizzazione frazionata.
In alternativa sono stati progettati processi chimici ed elettrochimici selettivi per il recupero di cloruro, idrossido o carbonato di litio ad alta purezza che cercano di ridurre i tempi di processo e diminuire l’impatto ambientale per perdita d’acqua e formazione di rifiuti nocivi per l’ambiente.
Recentemente è stato proposto un metodo rapido basato sulla precipitazione di fosfato di litio, Li3PO4 poco solubile (0,39 g/l) tramite trattamento delle salamoie con acido fosforico; poi si tratta il fosfato di litio insolubile con calce per formare idrossiapatite molto insolubile e recuperare idrossido di litio solubile.
3Li3PO4 + 5Ca(OH)2 → Ca5(PO4)3.OH + 9LiOH
Processi di estrazione del litio dai depositi nei salares argentini. In questo processo l’acido fosforico viene recuperato trattando l’idrossiapatite con acido solforico, con formazione di solfato di calcio idrato (gesso) che ha applicazioni in edilizia:
Ca5(PO4)3.OH + 5H2SO4 → 5CaSO4.2H2O + H3PO4
Questo metodo è stato brevettato dall’azienda siderurgica coreana Posco, che ha installato un impianto pilota a Cachauri, Jujuy, nel 2015.
Il metodo non tratta le salamoie per evaporazione, per cui è significativamente più veloce dei metodi evaporativi, tuttavia, poiché utilizza acido fosforico, che sebbene venga recuperato, può lasciare residui di fosfati di magnesio e calcio sotto forma di fanghi inquinanti.
Metodi di adsorbimento
È stato ampiamente studiato l’adsorbimento selettivo del litio contenuto in salamoie (300-1000 ppm) e acqua di mare (0,125 ppm) utilizzando adsorbenti come MnO2, TiO2, idrossido di alluminio, ecc.
La captazione di litio in questi sistemi dipende dall’intercalazione degli ioni litio in reti non stechiometriche di questi ossidi con una capacità che varia a seconda del tipo di adsorbente da 3 a 35 mg/g. Quando si estrae da soluzioni ricche di ioni litio come le salamoie (> 5 mg/L) si possono raggiungere captazioni di > 20 mg/g.
Conclusioni
Il livello attuale di riciclaggio delle batterie agli ioni di litio è ancora limitato, sotto l’1%, e ci sono poche aziende lungo la catena di fornitura in Europa che sono attivamente coinvolte nel recupero di metalli strategici presenti nelle batterie.
Dovrebbero i produttori farsi carico del costo del riciclaggio del litio? O dovremmo essere noi consumatori a pagare una ecotassa per questo?
Qualunque sia la risposta, ciò che risulta evidente è che le tecniche di riciclaggio di questi materiali devono essere perfezionate, al punto da renderle redditizie e produrre il minimo impatto ambientale.
Stiamo andando verso un mondo con sempre maggiore scarsità di risorse naturali, se inoltre sprechiamo quelle che ci sono utili, arriverà il momento in cui non le avremo più.
Se ora ci lamentiamo che le batterie sono costose con litio abbondante, cosa succederebbe se questo metallo iniziasse a scarseggiare perché lo abbiamo sepolto nel cemento?