Seccions
- Introducció
- Característiques del bor
- Principals productors mundials
- Impacte del bor en el medi ambient
- Tractament d’efluents amb bor
- Resum
Introducció
El bor és un metaloide que es combina fàcilment en diferents formes a causa de tenir tres electrons lliures en l’últim orbital, que li donen un caràcter molt reactiu. Els compostos de bor (de l’àrab buraq i aquest del persa burah) es coneixen des de fa milers d’anys. A l’antic Egipte, la momificació depenia del natró, un mineral que contenia borats i altres sals comunes.
A la Xina s’utilitzaven ja cristalls de bórax cap al 300 a. C., i a l’antiga Roma s’utilitzaven compostos de bor en la fabricació de vidre. A partir del segle VIII els borats van ser usats en processos de refineria d’or i plata.
El 1808 Humphry Davy, Gay-Lussac i L. J. Thenard van obtenir bor amb una puresa aproximada del 50%, encara que cap d’ells va reconèixer la substància com un nou element, cosa que faria Jöns Jacob Berzelius el 1824.
El bor pur va ser produït per primera vegada pel químic nord-americà W. Weintraub el 1909.
La importància dels productes del bor es veu reflectida en la gran varietat d’aplicacions que posseeixen. Els principals usos dels borats i compostos de bor són: a la indústria d’esmalt i ceràmiques (sanitaris, vaixelles, ceràmics, rajoles), indústria del vidre, cristalls i fibres de vidre, vidres Pyrex per a utensilis, làmpades i focus, detergents i blanquejadors, retardadors de foc, abrasius, cosmètics, en la preservació de la fusta, en capacitors, aliatges, catàlisi, cautxú (ignífug), ciment (disminueix la velocitat d’enduriment), combustible (borà per a avions i coets), adoberies (evita putrefacció), farmàcia (antiséptic suau), pintures (fungicida), aplicacions nuclears, en òptica, etc. A més d’aquests usos industrials, el bor és un dels 7 micronutrients essencials per a les plantes, per la qual cosa la dosificació del bor com a fertilitzant adquireix suma importància.
El borofè és un dels materials de moda. Fa uns 5-6 anys, el grafè semblava acaparar l’interès mundial a nivell de materials punters per al desenvolupament tecnològic però actualment el borofè es postula com un gran candidat a desbancar-lo, sobretot en matèria de nanotecnologia.
El bor a l’escorça terrestre
La concentració estimada del bor a l’escorça terrestre és de 10 ppm, i la seva massa de 2,4 × 1017 kg.
Actualment se sap que el bor és molt més abundant en roques sedimentàries (300 ppm) que en roques ígnies (3 ppm), aquesta diferència és conseqüència de quatre característiques: el bor és sublimable, la no preferència del bor per les fases foses (element incompatible), la seva alta mobilitat en la fase aquosa i la seva forta afinitat per minerals argilosos (element litòfil).
El bor arriba a l’escorça terrestre a través de diferents vies, i aquestes són la precipitació atmosfèrica, que conté petites quantitats de bor en dissolució; i el vulcanisme i l’activitat geològica anàloga, que alliberen roca fosca amb concentracions variables de bor.
També hi ha fluxos de l’oceà a l’escorça oceànica en forma de sedimentació i diagènesi. Les vies de sortida del bor curtical són l’erosió i els processos de subducció de plaques.
El bor tendeix a concentrar-se en les fases residuals de la part fosca, els elements que componen la massa de magma solidifiquen en funció del seu punt de fusió i de la seva compatibilitat amb la fase sòlida, d’aquesta manera, en els successius estadis de la solidificació, la concentració dels elements incompatibles (entre ells el bor) va augmentant en el magma, fins que finalment tenim un líquid format per elements incompatibles que acaben solidificant-se.
Aquests dipòsits d’elements incompatibles són els que coneixem pel nom de pegmatites. Obedint a aquest fet les concentracions del bor són relativament baixes en basaltos (6-0,1 ppm) i més altes en roques més cristal·litzades com el granit (85 ppm) encara que també es troben altes concentracions de bor en granits derivats de roques sedimentàries riques en bor. Les pegmatites poden contenir concentracions de bor de 1360 ppm.
Durant el deteriorament de roques submarines, les roques ígnies es degraden i formen minerals argilosos que adsorbeixen bor de l’aigua marina, d’aquesta manera s’enriqueix en bor la massa de roca.
Els basaltos de les illes magmàtiques tendeixen a estar enriquits en bor; aquest enriquiment s’atribueix a la deshidratació dels blocs rocosos subduïts, rics en bor adsorbit per minerals argilosos.
Les fraccions riques en bor prenen part en el procés de fusió i les roques volcàniques resultants (andesites i diorites) estan conseqüentment enriquides en bor. Minerals argilosos (tals com il·lites, esmectites i montmorillonites) incorporen bor de l’aigua tant per adsorció com en forma d’element de substitució en l’estructura.
Les roques sedimentàries dels oceans tendeixen a contenir més bor que les roques sedimentàries fluvials ja que l’aigua marina conté major concentració de bor que les aigües continentals.
El bor és adsorbit només a temperatures inferiors a 40 °C, a més altes temperatures (>150 °C) pot ser alliberat del mineral, per això, durant el metamorfisme de roques sedimentàries molt del bor adsorbit és alliberat en l’aigua, i si s’incrementa encara més el metamorfisme el bor com a element substituent és també alliberat, per tant els sediments metamòrfics tendeixen a contenir concentracions de bor àmpliament menors que les roques sedimentàries equivalents.
Els minerals principals en què trobem bor són en la seva majoria roques evaporítiques, com el bórax, altament soluble en aigua; la colemanita; la kernita (una forma parcialment deshidratada del bórax) i la ulexita.
També existeixen importants minerals del bor en forma de jaciments de roques ígnies, la datolita, el chorlo i l’elbanita, aquests minerals es classifiquen en el grup dels borats (sals inorgàniques compostes per bor i altres ions), exceptuant els dos últims minerals esmentats, els quals pertanyen al grup de les turmalines, que apareixen especialment en filons del tipus pegmatític.
El bor a la hidròsfera
El bor es troba a l’aigua marina en concentracions estimades en 4,6 ppm i en una massa de 5,4 × 1015 kg.
Ho fa com a component de dues molècules hidratades; el B(OH)3 trigonal i el B(OH)4- tetraèdric.
La proporció de les dues formes depèn del pH de l’aigua de mar i l’equilibri entre les concentracions de les dues formes es troba en pH de 8,7-8,8, en medis més bàsics predomina la forma tetraèdrica i en medis més àcids la trigonal.
Degut al gran temps de residència del bor a l’aigua de mar (25 milions d’anys), les concentracions de B(OH)3 i B(OH)4- no varien significativament en els diferents oceans.
El bor arriba a la hidròsfera des dels continents mitjançant el cicle de l’aigua i per processos d’erosió de roques, i des de l’escorça oceànica per circulació hidrotermal, a més també procedeix de la precipitació atmosfèrica.
El bor a l’atmosfera
L’atmosfera conté uns 2,7 × 108 kg de bor. Aquest es troba a la troposfera en estat gasós en un 97%; el 3% restant es troba en estat sòlid en forma de partícules.
Els temps de residència que es consideren per al bor troposfèric en la seva forma gasosa són de 19 a 36 dies, per al bor particulat són de 2 a 6 dies. Degut a aquests temps de residència tan baixos les concentracions de bor són variables en diferents punts de l’atmosfera.
El bor arriba a l’atmosfera a través de l’evaporació de l’aigua marina, llavors pot tornar als oceans o als continents per precipitació.
El bor a les plantes
Per a les plantes el bor és un nutrient essencial. Sembla tenir un paper fonamental en el manteniment de l’estructura de la paret cel·lular (mitjançant formació de grups cis-diol) i de les membranes.
És un element poc mòbil al floema, per això els símptomes de deficiència solen aparèixer a les fulles joves i els de toxicitat a les fulles madures.
Un excés de bor és perjudicial per a algunes plantes poc tolerants a aquest element, podent actuar en les seves nervadures debilitant-les. En els pomers i perers la deficiència de bor es manifesta en els fruits com una malformació interna.
Característiques del bor
Les principals característiques físiques i químiques del bor són les següents:
| Nom, símbol, número | Bor, B, 5 |
| Sèrie química | Metaloides |
| Grup, període, bloc | 13, 2, p |
| Massa atòmica | 10,811(7) u |
| Configuració electrònica | [He]2s22p1 |
| Duresa Mohs | 9,5 |
| Electrons per nivell | 2, 3 |
| Radi mitjà | 85 pm |
| Electronegativitat | 2,04 (escala de Pauling) |
| Radi atòmic (calc) | 87 pm (radi de Bohr) |
| Radi covalent | 82 pm |
| Estat(s) d’oxidació | 3 (lleugerament àcid) |
| Estat ordinari | Sòlid (no magnètic) |
| Densitat | 2460 kg/m3 |
| Punt de fusió | 2349 K (2076 ℃) |
| Punt d’ebullició | 4200 K (3927 ℃) |
El bor presenta multitud de formes alotrópiques que tenen com a element estructural comú un icosaedre regular. L’ordenació dels icosaedres pot ser de dues formes diferents:
- Unió de dos icosaedres per dos vèrtexs, mitjançant enllaços covalents normals B – B
- Unió de tres icosaedres per tres vèrtexs, mitjançant un enllaç de tres centres amb dos electrons.
Dins d’aquestes possibles unions, en el bor cristal·lí els icosaedres poden associar-se de diverses maneres per originar els alòtrops corresponents:
- Bor tetragonal (T – 50): format per 50 àtoms de bor per cel·la unitat, que són quatre unitats icosaèdriques unides entre si per alguns enllaços B – B i de dos boros elementals que actuen com a unió tetraèdrica entre icosaedres. Posseeix una densitat de 2,31 g/cm3.
- Bor romboèdric alfa (R – 12): està format per làmines d’icosaedres unides paral·lelament. Les unions intralaminars s’efectuen per mitjà d’enllaços de tres centres, mentre que les unions interlaminars es produeixen mitjançant enllaços de dos centres. La densitat d’aquest tipus de bor és de 2,46 g/cm3, i presenta un color vermell clar.
- Bor romboèdric beta (R – 105): format per dotze icosaedres B12 ordenats en forma icosaèdrica al voltant d’una unitat central de B12, és a dir, B12(B12)12. Presenta una densitat de 2,35 g/cm3.
Isòtops del bor
A la natura es troben dos isòtops de bor, 11B (80,1%) i 10B (19,9%).
Els resultats de les seves masses es diferencien en una àmplia gamma de valors que es defineixen com la diferència entre les fraccions 11B i 10B i tradicionalment expressada en parts per mil, en aigües naturals que van des de -16 fins a 59.
Hi ha 13 isòtops coneguts de bor, l’isòtop de més curta durada és 7B que es descompon a través d’emissió de protons i la desintegració alfa.
Té una vida mitjana de 3.5×10−22s. El fraccionament isotòpic del bor és controlat per les reaccions de canvi dels compostos especials B(OH)3 i B(OH)4.
Els isòtops de bor també es fraccionen durant la cristal·lització de minerals, durant els canvis de fase de H2O en sistemes hidrotermals, i durant l’alteració hidrotermal de roques.
Principals productors mundials
El bor origina diversos compostos, des d’òxids simples a estructures molt complexes de tipus polimèric.
Entre ells es troben els òxids denominats borats. Els jaciments de borats d’importància comercial es localitzen només en un reduït nombre de regions geogràfiques al món: Anatòlia (Turquia), Califòrnia i Nevada (sud-oest dels Estats Units), la Puna Sud-americana (sud del Perú, sud-oest de Bolívia, nord de Xile i nord-oest d’Argentina), Inder (Rússia) i Àsia Central (Xina i Rússia).
La Puna Sud-americana posseeix les terceres reserves mundials de borats, després de Turquia i la costa oest dels Estats Units.
Els jaciments de la Puna Sud-americana produeixen preferentment ulexita, tincal, colemanita i hidroboracita. Aquests constitueixen el mineral útil, de valor comercial, que es troba barrejat amb altres materials sense valor que constitueixen la ganga, dels quals ha de ser separat.
L’ulexita és un borat de sodi i calci, poc soluble en aigua freda, acompanyat per ganga constituïda per sorres, argiles, guix, calcita, tot impregnat en una salmorra composta principalment per clorurs i sulfats de sodi. Els borats coneguts com a “durs” (tincal, colemanita i hidroboracita) posseeixen ganga constituïda per roques (calcita, dragonita, argila, toves, tufites) i impureses de ferro.
El tincal és un borat de sodi, soluble en aigua, propietat que s’utilitza per separar-lo de la ganga insoluble, i obtenir posteriorment bórax mitjançant cristal·lització per refredament. La colemanita és un borat de calci amb cinc molècules d’aigua en la seva estructura i la hidroboracita és un borat de calci i magnesi amb sis molècules d’aigua. Ambdues tenen com a impureses principals ferro i arsènic.
Impacte del bor en el medi ambient
Ni el bor ni els borats són tòxics per als éssers humans i animals. La DL50 per als animals és d’uns 6 g per kg de pes corporal. Les substàncies amb LD50 per sobre de 2 g es consideren no tòxiques.
La dosi mínima letal per als éssers humans no ha estat establerta, però un consum de 4 g/dia es va reportar sense incidents, i les dosis clíniques de 20 g d’àcid bòric per a la teràpia per captura de neutrons no van causar problemes.
Alguns peixos han sobreviscut durant 30 minuts en una solució saturada d’àcid bòric i poden sobreviure més temps en solucions de bórax. Els borats són més tòxics per als insectes que en els mamífers.
El borà i alguns compostos gasosos similars són molt verinosos. No és un element que sigui intrínsecament verinós, però la seva toxicitat depèn de l’estructura.
Els borans (compostos de bor d’hidrogen) són tòxics, així com fàcilment inflamables i requereixen cures especials durant la seva manipulació. El borohidruro de sodi presenta un perill d’incendi a causa del seu caràcter reductor, i la liberació d’hidrogen en contacte amb l’àcid. Els halurs de bor són corrosius.
El bor en la salut humana
Científicament no s’ha demostrat que el bor sigui una substància considerada essencial en la dieta humana o que sigui un requeriment dietari en vertebrats i invertebrats, o almenys de la mateixa importància que ocupa en els vegetals.
El cos humà conté almenys 0,7 mg per quilo de pes de Bor obtingut del consum d’aigua i vegetals. Un humà consumeix en la seva ingesta diària uns 0,8 a 2,5 mg de bor per quilo de pes sense que es manifesti cap símptoma per això.
Dietes forçades de 5 g al dia poden causar nàusees, diarrea i vòmits; alguns autors suggereixen que 20 g al dia de bor pot ser mortal en organismes sensibles, però no s’ha comprovat.
Altres bibliografies semblen associar l’aparició d’artritis per la ingesta d’aquest element i altres publicacions estimen que aquest element ha de ser considerat a nivell d’element essencial per al metabolisme de calci, coure, magnesi i la fixació de nitrogen.
El bor pot ser tòxic per als vegetals, fins i tot amb nivells baixos de concentració. Una concentració de bor inferior a 1 mg/l és essencial per al desenvolupament de les plantes. La majoria de les plantes mostren problemes de toxicitat quan la concentració de bor excedeix els 2 mg/l.
L’Organització Mundial de la Salut recomana una concentració de bor en aigua potable inferior a 0,5 mg/l. Els estàndards de la UE requereixen un nivell de bor inferior a 1 mg/l.
Tractament d’efluents amb bor
El bor, a causa de la seva naturalesa, no és fàcil d’eliminar de les matrius aquoses. Les tècniques clàssiques de coagulació, sedimentació i fins i tot per òsmosi inversa no són satisfactòries.
Algunes experiències han assenyalat que l’aplicació de sistemes de resines d’intercanvi iònic conjuntament amb zeolites i carbó activat són molt més prometedores com a formes de reduir aquest element.
Taula de tractaments habituals d’efluents amb bor
| Mètode | Concentració inicial bor | Eficàcia | Procés | Aplicació industrial | Costos relatius |
| Precipitació alcalina | Alta | Baixa | Discontinu | Baixa | Molt baixos |
| Adsorció Me(OH)x | Alta | Molt alta | Discontinu | Alta | Baixos |
| Adsorció sobre argila | Alta | Molt alta | Discontinu | Mitjana | Baixos |
| Intercanvi iònic | Baixa | Molt alta | Continu (regeneració) | Alta | Alts |
| Extracció | Baixa | Alta | Continu | Baixa | Alts |
| Òsmosi inversa | Baixa | Alta | Continu (neteja) | Alta | Alts |
| Electrodiàlisi | Baixa | Alta | Continu | Baixa | Alts |
| Evaporació | Alta | Alta | Continu | Mitjana | Alts |
Les solucions més utilitzades són: Òsmosi inversa, Intercanvi iònic i el tractament dels efluents amb Evaporació.
La dessalació per òsmosi inversa
La quantitat de bor a l’aigua de mar varia de 4 a 5,5 mg/L, proporcional a la salinitat. Prové principalment de la descàrrega de les plantes de tractament d’aigua residual, on es comencen a utilitzar sabons i detergents, així com dels fertilitzants agrícoles.
El bor està present a l’aigua com a àcid bòric H3BO3 i borat H3BO2-. L’espècie de bor predominant depèn del pH de l’aigua.
El valor pKa de H3BO3/H3BO2- és 9,2, per tant, l’equilibri està normalment desplaçat a l’esquerra, ja que el valor de pH estàndard de l’aigua de mar és 8.
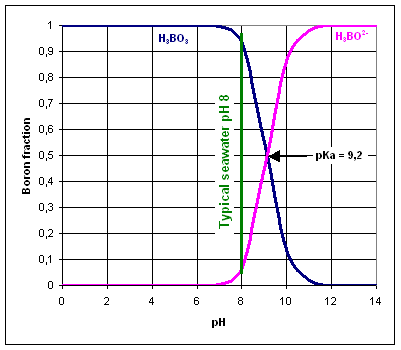
Les membranes d’òsmosi inversa són molt eficients en l’eliminació d’espècies carregades com l’ió borat, en lloc de molècules neutres com l’àcid bòric.
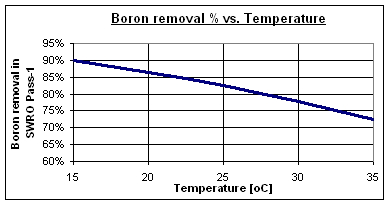
Les taxes típiques d’eliminació de bor a pH 8 són entre 73 i 90% per a membranes estàndard d’òsmosi inversa d’aigua de mar d’alt rebuig, depenent de la temperatura de l’aigua. Algunes membranes especials d’alta eliminació de bor poden assolir valors de fins al 95%.
Normalment l’aigua de mar d’alta salinitat té alt contingut en bor i es troben en àrees amb clima molt càlid, com el Golf Pèrsic, el Mar Roig, el Mar Mediterrani oriental i el Mar Carib.
A 30 °C, l’eliminació de bor es redueix al 78%, deixant 1,15 mg/l en el corrent de permeat del Pas-1. Per tant, és necessari un procés específic d’eliminació de bor per assolir els 0,5 mg/l exigits per l’OMS.
Eliminació del bor de l’aigua dessalada
Hi ha dos processos principals per produir aigua potable amb menys de 0,5 mg/L de bor, depenent de la salinitat de l’aigua, la concentració de bor i la temperatura.
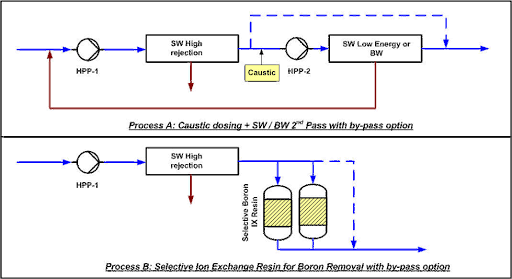
Procés A: SWRO de 2 passos:
En el pas-2 d’òsmosi inversa s’afegeix sosa càustica per pujar el pH a 9,5. Part del permeat del pas-1 pot ser bypassat per mantenir certa quantitat de minerals a l’aigua. El segon pas pot estar compost per membranes d’aigua de mar de baixa energia si la temperatura i salinitat són elevades o membranes d’alt rebuig d’aigua salobre en cas de condicions menys severes.
Procés B: SWRO+ IX:
S’afegeix una resina d’intercanvi iònic amb o sense bypass, depenent de la concentració de bor residual necessària. La resina, que ha de ser selectiva per al clor, es regenera in situ amb sosa càustica i àcid clorhídric. Perquè la producció sigui de forma contínua, és necessari un sistema de doble columna.
El sistema de tractament d’eliminació de bor per ió selectiu permet eliminar de qualsevol aigua, l’excés d’aquest element, que, en determinats cultius (fonamentalment fruiters de pinyol o de poma), la seva alta concentració pot arribar a ser tòxica o nociu per a la plantació.
Aquesta toxicitat pot tenir major incidència, quan s’utilitzen aigües residuals per al regadiu, o subterrànies contaminades per aquestes últimes.
L’afluent travessa la resina d’intercanvi iònic, especialment dissenyada per a l’eliminació del bor en solucions aquoses, amb la qual cosa a la sortida s’obté una aigua amb una reducció de bor del 90%.
La capacitat d’intercanvi està limitada i quan la resina ha arribat al seu esgotament s’efectua la seva regeneració.
La regeneració de les resines està totalment automatitzada i s’efectua mitjançant el pas d’una determinada concentració d’àcid a través del llit de resines, eliminant d’aquestes el bor retingut, possibilitant l’emmagatzematge de la solució aquosa de la regeneració, de manera que es pugui gestionar com a residu posteriorment.
Els efluents rics en bor procedents de les resines o membranes d’òsmosi inversa es poden concentrar fins a valors que permetin la seva recuperació, mitjançant tècniques de evaporació a buit. Condorchem – Envitech té capacitat per oferir solucions integrals per a aquesta aplicació.
Resum
El bor és un element químic molt reactiu que apareix a la natura combinat en diverses formes. Té múltiples aplicacions industrials i un futur important basat en l’aparició del borofè, com a successor del grafè, les propietats del qual el fan ferm candidat per a aplicacions nanotecnològiques.
Malgrat ser necessari per a la vida de les plantes, i ser ben tolerat pels éssers humans i els animals, existeixen límits que no s’han de superar perquè no resulti nociu.
Una de les solucions tècniques que s’ha utilitzat des de fa molts anys per combatre la sequera, és la dessalació per òsmosi inversa, però el concentrat és ric en aquest element i a més l’aigua dessalada sol quedar per sobre de les 0,5 ppm establertes com a límit màxim per l’OMS, la qual cosa requereix de tractaments complementaris que separen més bor.
Així les opcions consisteixen a fer passar el permeat per un segon pas d’òsmosi inversa, o bé per un llit de resines específiques. En el cas de les resines s’elimina la pràctica totalitat del bor present.
En ambdós casos queda un concentrat que podrà ser recuperat prèvia concentració en un sistema d’evaporació a buit, en què Condorchem, – Envitec té provada experiència.
Referències bibliogràfiques i a Internet
http://oa.upm.es/155/1/05200006.pdf
https://rua.ua.es/dspace/bitstream/10045/13838/1/Tesis_Chillon.pdfçç