Abschnitte
- Einführung
- Eigenschaften von Bor
- Wichtigste globale Produzenten
- Auswirkungen von Bor auf die Umwelt
- Abwasserbehandlung mit Bor
- Zusammenfassung
Einführung
Bor ist ein Halbmetall, das sich aufgrund seiner drei freien Elektronen in der äußeren Schale leicht in verschiedenen Formen verbindet, was ihm einen sehr reaktiven Charakter verleiht. Borverbindungen (vom arabischen buraq und diesem vom persischen burah) sind seit Tausenden von Jahren bekannt. Im alten Ägypten hing die Mumifizierung von Natron ab, einem Mineral, das Borate und andere häufige Salze enthielt.
In China wurden bereits um 300 v. Chr. Boraxkristalle verwendet, und im antiken Rom wurden Borverbindungen in der Glasherstellung eingesetzt. Ab dem 8. Jahrhundert wurden Borate in Gold- und Silberraffinationsprozessen verwendet.
Im Jahr 1808 gewannen Humphry Davy, Gay-Lussac und L. J. Thenard Bor mit einer ungefähren Reinheit von 50 %, obwohl keiner von ihnen die Substanz als neues Element erkannte, was Jöns Jacob Berzelius 1824 tat.
Reines Bor wurde erstmals 1909 vom amerikanischen Chemiker W. Weintraub hergestellt.
Die Bedeutung von Borprodukten spiegelt sich in der Vielzahl ihrer Anwendungen wider. Die Hauptanwendungen von Boraten und Borverbindungen sind: in der Email- und Keramikindustrie (Sanitärkeramik, Geschirr, Keramik, Fliesen), Glasindustrie, Kristallen und Glasfasern, Pyrex-Glas für Utensilien, Lampen und Glühbirnen, Reinigungsmitteln und Bleichmitteln, Flammschutzmitteln, Schleifmitteln, Kosmetika, Holzschutz, Kondensatoren, Legierungen, Katalyse, Gummi (Flammschutz), Zement (verzögert die Abbindezeit), Treibstoff (Borane für Flugzeuge und Raketen), Gerbereien (verhindert Fäulnis), Pharmazie (mildes Antiseptikum), Farben (Fungizid), Kernanwendungen, Optik usw. Neben diesen industriellen Anwendungen ist Bor eines der 7 essentiellen Mikronährstoffe für Pflanzen, was die Dosierung von Bor als Dünger äußerst wichtig macht.
Borophen ist eines der angesagten Materialien. Vor etwa 5-6 Jahren schien Graphen das globale Interesse auf dem Gebiet der Spitzentechnologie bei Materialien zu fesseln, aber derzeit tritt Borophen als starker Kandidat hervor, um seinen Platz einzunehmen, insbesondere im Bereich der Nanotechnologie.
Bor in der Erdkruste
Die geschätzte Bor-Konzentration in der Erdkruste beträgt 10 ppm bei einer Masse von 2,4 × 1017 kg.
Es ist heute bekannt, dass Bor in Sedimentgesteinen (300 ppm) viel häufiger vorkommt als in magmatischen Gesteinen (3 ppm). Dieser Unterschied beruht auf vier Eigenschaften: Bor ist sublimierbar, es gibt keine Bevorzugung von Bor in geschmolzenen Phasen (inkompatibles Element), seine hohe Mobilität in der wässrigen Phase und seine starke Affinität zu Tonmineralien (lithophiles Element).
Bor gelangt auf verschiedenen Wegen in die Erdkruste, darunter atmosphärische Niederschläge, die geringe Mengen an gelöstem Bor enthalten, sowie Vulkanismus und ähnliche geologische Aktivitäten, die geschmolzenes Gestein mit variablen Bor-Konzentrationen freisetzen.
Es gibt auch Flüsse vom Ozean zur ozeanischen Kruste in Form von Sedimentation und Diagenese. Die Wege, auf denen Bor die Kruste verlässt, sind Erosion und Plattensubduktion.
Bor neigt dazu, sich in den Restphasen des geschmolzenen Teils zu konzentrieren; die Elemente, aus denen die Magmamasse besteht, erstarren entsprechend ihrem Schmelzpunkt und ihrer Kompatibilität mit der festen Phase. So steigt in den aufeinanderfolgenden Erstarrungsphasen die Konzentration inkompatibler Elemente (einschließlich Bor) im Magma, bis schließlich eine Flüssigkeit aus inkompatiblen Elementen entsteht, die schließlich erstarrt.
Diese Lagerstätten inkompatibler Elemente sind als Pegmatite bekannt. Dementsprechend sind Bor-Konzentrationen in Basalten relativ niedrig (6-0,1 ppm) und höher in stärker kristallisierten Gesteinen wie Granit (85 ppm), obwohl auch in Graniten, die von borreichen Sedimentgesteinen abstammen, hohe Bor-Konzentrationen vorkommen. Pegmatite können Bor-Konzentrationen von 1360 ppm enthalten.
Beim Verfall submariner Gesteine zersetzen sich magmatische Gesteine und bilden Tonminerale, die Bor aus Meerwasser adsorbieren und so die Gesteinsmasse mit Bor anreichern.
Die Basalte magmatischer Inseln neigen dazu, mit Bor angereichert zu sein; diese Anreicherung wird der Dehydratisierung subduzierter, borreicher Gesteinsblöcke zugeschrieben, die von Tonmineralien adsorbiert werden.
Borreiche Fraktionen nehmen am Schmelzprozess teil, und die resultierenden vulkanischen Gesteine (Andesite und Diorite) sind folglich mit Bor angereichert. Tonminerale (wie Illite, Smektite und Montmorillonite) nehmen Bor aus Wasser sowohl durch Adsorption als auch als Substituent in ihrer Struktur auf.
Sedimentgesteine in Ozeanen enthalten tendenziell mehr Bor als Flusssedimente, da Meerwasser eine höhere Bor-Konzentration als Kontinentalwasser aufweist.
Bor wird nur bei Temperaturen unter 40 °C adsorbiert; bei höheren Temperaturen (>150 °C) kann es aus dem Mineral freigesetzt werden. Daher wird während der Metamorphose von Sedimentgesteinen ein Großteil des adsorbierten Bors ins Wasser freigesetzt, und bei weiterer Metamorphose wird auch Bor als Substituent freigesetzt. Metamorphe Sedimente enthalten daher deutlich geringere Bor-Konzentrationen als ihre sedimentären Äquivalente.
Die wichtigsten Minerale, in denen Bor vorkommt, sind meist evaporitische Gesteine wie Borax, das in Wasser sehr gut löslich ist; Colemanit; Kernit (eine teilweise dehydratisierte Form von Borax); und Ulexit.
Es gibt auch bedeutende Bor-Minerale in Form von magmatischen Lagerstätten, wie Datolith, Turmalin und Elbait. Diese Minerale gehören zur Boratgruppe (anorganische Salze, die aus Bor und anderen Ionen bestehen), mit Ausnahme der letzten beiden genannten Minerale, die zur Turmalingruppe gehören und besonders in pegmatitischen Adern vorkommen.
Bor in der Hydrosphäre
Bor kommt im Meerwasser in geschätzten Konzentrationen von 4,6 ppm und in einer Masse von 5,4 × 1015 kg vor.
Es existiert als Bestandteil zweier hydratisierter Moleküle: trigonal B(OH)3 und tetraedrisch B(OH)4-.
Das Verhältnis der beiden Formen hängt vom pH-Wert des Meerwassers ab, und das Gleichgewicht zwischen den Konzentrationen der beiden Formen liegt bei einem pH von 8,7-8,8. In basischeren Medien dominiert die tetraedrische Form, während in sauren Medien die trigonal Form vorherrscht.
Aufgrund der langen Verweilzeit von Bor im Meerwasser (25 Millionen Jahre) variieren die Konzentrationen von B(OH)3 und B(OH)4- in verschiedenen Ozeanen nicht signifikant.
Bor gelangt durch den Wasserkreislauf von den Kontinenten in die Hydrosphäre und durch Prozesse der Gesteinserosion sowie durch hydrothermale Zirkulation aus der ozeanischen Kruste und durch atmosphärische Niederschläge.
Bor in der Atmosphäre
Die Atmosphäre enthält etwa 2,7 × 108 kg Bor. Es befindet sich zu 97 % gasförmig in der Troposphäre; die restlichen 3 % liegen als Partikel fest vor.
Die Verweilzeiten für gasförmiges Bor in der Troposphäre liegen zwischen 19 und 36 Tagen, für partikuläres Bor zwischen 2 und 6 Tagen. Aufgrund dieser kurzen Verweilzeiten sind die Bor-Konzentrationen an verschiedenen Punkten der Atmosphäre variabel.
Bor gelangt durch Verdunstung von Meerwasser in die Atmosphäre und kann durch Niederschlag wieder in die Ozeane oder Kontinente zurückkehren.
Bor in Pflanzen
Für Pflanzen ist Bor ein essentieller Nährstoff. Es scheint eine grundlegende Rolle bei der Erhaltung der Zellwandstruktur (durch Bildung von cis-Diol-Gruppen) und der Membranen zu spielen.
Es ist ein wenig bewegliches Element im Phloem, weshalb Mangelerscheinungen meist an jungen Blättern auftreten, während Toxizitätssymptome an reifen Blättern sichtbar werden.
Ein Überschuss an Bor ist für einige weniger tolerante Pflanzen schädlich und kann ihre Leitbündel schwächen. Bei Apfel- und Birnbäumen äußert sich Bor-Mangel in den Früchten durch innere Fehlbildungen.
Eigenschaften von Bor
Die wichtigsten physikalischen und chemischen Eigenschaften von Bor sind wie folgt:
| Name, Symbol, Nummer | Bor, B, 5 |
| Chemische Reihe | Halbmetalle |
| Gruppe, Periode, Block | 13, 2, p |
| Atommasse | 10.811(7) u |
| Elektronenkonfiguration | [He]2s22p1 |
| Mohshärte | 9,5 |
| Elektronen pro Schale | 2, 3 |
| Mittlerer Radius | 85 pm |
| Elektronegativität | 2,04 (Pauling-Skala) |
| Berechneter Atomradius | 87 pm (Bohr-Radius) |
| Kovalenter Radius | 82 pm |
| Oxidationszustand(e) | 3 (leicht sauer) |
| Normalzustand | Fest (nicht magnetisch) |
| Dichte | 2460 kg/m3 |
| Schmelzpunkt | 2349 K (2076 °C) |
| Siedepunkt | 4200 K (3927 °C) |
Bor zeigt eine Vielzahl von Allotropen, die ein regelmäßiges Ikosaeder als gemeinsames Strukturelement besitzen. Die Anordnung der Ikosaeder kann in zwei unterschiedlichen Formen erfolgen:
- Verbindung von zwei Ikosaedern über zwei Ecken durch normale kovalente B-B-Bindungen
- Verbindung von drei Ikosaedern über drei Ecken durch eine Drei-Zentren-Bindung mit zwei Elektronen.
Innerhalb dieser möglichen Verbindungen können sich in kristallinem Bor die Ikosaeder auf verschiedene Weise assoziieren, um die entsprechenden Allotrope zu bilden:
- Tetragonales Bor (T – 50): gebildet aus 50 Boratomen pro Elementarzelle, die vier Ikosaedereinheiten sind, die durch einige B-B-Bindungen verbunden sind, sowie zwei elementare Boratome, die als tetraedrische Verbindungen zwischen den Ikosaedern fungieren. Es hat eine Dichte von 2,31 g/cm3.
- Alpha-Rhomboedrisches Bor (R – 12): gebildet aus Schichten von Ikosaedern, die parallel verbunden sind. Die intralaminar Verbindungen erfolgen durch Drei-Zentren-Bindungen, während die interlaminar Verbindungen durch Zwei-Zentren-Bindungen erfolgen. Die Dichte dieses Bors beträgt 2,46 g/cm3 und es hat eine hellrote Farbe.
- Beta-Rhomboedrisches Bor (R – 105): gebildet aus zwölf B12-Ikosaedern, die in einer ikosaedrischen Form um eine zentrale B12-Einheit angeordnet sind, also B12(B12)12. Es hat eine Dichte von 2,35 g/cm3.
Isotope von Bor
In der Natur gibt es zwei Isotope von Bor, 11B (80,1 %) und 10B (19,9 %).
Die Ergebnisse ihrer Massen unterscheiden sich über einen weiten Bereich, definiert als Differenz zwischen den Anteilen von 11B und 10B, traditionell in Tausendsteln ausgedrückt, in natürlichen Gewässern von -16 bis 59.
Es sind 13 bekannte Isotope von Bor bekannt, wobei das kurzlebigste Isotop 7B ist, das durch Protonenemission und Alphazerfall zerfällt.
Es hat eine Halbwertszeit von 3,5×10−22s. Die isotopische Fraktionierung von Bor wird durch Austauschreaktionen der speziellen Verbindungen B(OH)3 und B(OH)4 gesteuert.
Bor-Isotope werden auch während der Kristallisation von Mineralien, bei Phasenänderungen von H2O in hydrothermalen Systemen und bei der hydrothermalen Alteration von Gesteinen fraktioniert.
Wichtigste globale Produzenten
Bor stammt aus verschiedenen Verbindungen, von einfachen Oxiden bis hin zu sehr komplexen polymeren Strukturen.
Dazu gehören die Oxide, die als Borate bekannt sind. Kommerziell bedeutende Boratlagerstätten befinden sich nur in einer begrenzten Anzahl geografischer Regionen weltweit: Anatolien (Türkei), Kalifornien und Nevada (Südwesten der USA), die südamerikanische Puna (Süden Perus, Südwesten Boliviens, Norden Chiles und Nordwesten Argentiniens), Inder (Russland) und Zentralasien (China und Russland).
Die südamerikanische Puna verfügt über die drittgrößten Boratreserven der Welt, nach der Türkei und der Westküste der USA.
Die Lagerstätten in der südamerikanischen Puna produzieren bevorzugt Ulexit, Tinkal, Colemanit und Hydroboracit. Diese stellen das nutzbare Mineral von kommerziellem Wert dar, das mit anderen wertlosen Materialien vermischt ist, die das Gangartmaterial bilden und von dem es getrennt werden muss.
Ulexit ist ein Natrium- und Calciumborat, das in kaltem Wasser schlecht löslich ist, begleitet von Gangart, die aus Sanden, Tonen, Gips, Calcit besteht, alle in einer Sole, die hauptsächlich aus Natriumchloriden und Sulfaten besteht. Die als „hart“ bekannten Borate (Tinkal, Colemanit und Hydroboracit) haben eine Gangart aus Gesteinen (Calzit, Dragonit, Ton, Tuffe, Tufas) und Eisenverunreinigungen.
Tinkal ist ein Natriumborat, das in Wasser löslich ist, eine Eigenschaft, die zur Trennung von der unlöslichen Gangart und zur anschließenden Gewinnung von Borax durch Kühlkristallisation genutzt wird. Colemanit ist ein Calciumborat mit fünf Wassermolekülen in seiner Struktur, und Hydroboracit ist ein Calcium- und Magnesiumborat mit sechs Wassermolekülen. Beide enthalten Eisen und Arsen als Hauptverunreinigungen.
Auswirkungen von Bor auf die Umwelt
Weder Bor noch Borate sind für Menschen und Tiere giftig. Die LD50 für Tiere liegt bei etwa 6 g pro kg Körpergewicht. Substanzen mit einer LD50 über 2 g gelten als ungiftig.
Die minimale tödliche Dosis für Menschen wurde nicht festgelegt, aber ein Konsum von 4 g/Tag wurde ohne Zwischenfälle berichtet, und klinische Dosen von 20 g Borsäure für die Neutroneneinfangtherapie verursachten keine Probleme.
Einige Fische überlebten 30 Minuten in einer gesättigten Borsäurelösung und können in Boraxlösungen länger überleben. Borate sind für Insekten toxischer als für Säugetiere.
Borane und einige ähnliche gasförmige Verbindungen sind hochgiftig. Es handelt sich nicht um ein intrinsisch giftiges Element, sondern seine Toxizität hängt von der Struktur ab.
Borane (Wasserstoff-Bor-Verbindungen) sind giftig sowie leicht entflammbar und erfordern besondere Vorsicht bei der Handhabung. Natriumborhydrid stellt aufgrund seiner reduzierenden Eigenschaften und der Freisetzung von Wasserstoff bei Kontakt mit Säure eine Brandgefahr dar. Borhalogenide sind korrosiv.
Bor in der menschlichen Gesundheit
Wissenschaftlich wurde nicht nachgewiesen, dass Bor eine als essentiell betrachtete Substanz in der menschlichen Ernährung ist oder dass es ein Nährstoffbedarf bei Wirbeltieren und Wirbellosen ist, zumindest nicht in der gleichen Bedeutung wie bei Pflanzen.
Der menschliche Körper enthält mindestens 0,7 mg Bor pro Kilogramm Körpergewicht, das durch den Konsum von Wasser und Gemüse aufgenommen wird. Ein Mensch nimmt täglich etwa 0,8 bis 2,5 mg Bor pro Kilogramm Körpergewicht auf, ohne dass Symptome auftreten.
Erzwungene Diäten mit 5 g pro Tag können Übelkeit, Durchfall und Erbrechen verursachen; einige Autoren vermuten, dass 20 g Bor pro Tag für empfindliche Organismen tödlich sein können, dies wurde jedoch nicht bewiesen.
Andere Literatur scheint den Ausbruch von Arthritis mit der Aufnahme dieses Elements in Verbindung zu bringen, und weitere Veröffentlichungen schätzen, dass dieses Element als essentiell für den Stoffwechsel von Calcium, Kupfer, Magnesium und Stickstofffixierung betrachtet werden sollte.
Bor kann für Pflanzen bereits bei niedrigen Konzentrationen toxisch sein. Eine Bor-Konzentration unter 1 mg/l ist für die Pflanzenentwicklung essentiell. Die meisten Pflanzen zeigen Toxizitätsprobleme, wenn die Bor-Konzentration 2 mg/l überschreitet.
Die Weltgesundheitsorganisation empfiehlt eine Bor-Konzentration im Trinkwasser von weniger als 0,5 mg/l. Die EU-Normen verlangen einen Bor-Gehalt von weniger als 1 mg/l.
Abwasserbehandlung mit Bor
Bor ist aufgrund seiner Natur nicht leicht aus wässrigen Matrizen zu entfernen. Klassische Techniken wie Koagulation, Sedimentation und sogar Umkehrosmose sind nicht zufriedenstellend.
Einige Erfahrungen haben gezeigt, dass der Einsatz von Ionenaustauscherharzen in Kombination mit Zeolithen und Aktivkohle vielversprechender ist, um dieses Element zu reduzieren.
Tabelle der gängigen Behandlungen für Abwässer mit Bor
| Methode | Anfangskonzentration Bor | Wirksamkeit | Prozess | Industrielle Anwendung | Relative Kosten |
| Alkalische Fällung | Hoch | Niedrig | Diskontinuierlich | Niedrig | Sehr niedrig |
| Adsorption Me(OH)x | Hoch | Sehr hoch | Diskontinuierlich | Hoch | Niedrig |
| Adsorption auf Ton | Hoch | Sehr hoch | Diskontinuierlich | Mittel | Niedrig |
| Ionenaustausch | Niedrig | Sehr hoch | Kontinuierlich (Regeneration) | Hoch | Hoch |
| Extraktion | Niedrig | Hoch | Kontinuierlich | Niedrig | Hoch |
| Umkehrosmose | Niedrig | Hoch | Kontinuierlich (Reinigung) | Hoch | Hoch |
| Elektrodialyse | Niedrig | Hoch | Kontinuierlich | Niedrig | Hoch |
| Verdampfung | Hoch | Hoch | Kontinuierlich | Mittel | Hoch |
Die am häufigsten verwendeten Lösungen sind: Umkehrosmose, Ionenaustausch und Verdampfung von Abwässern.
Entsalzung durch Umkehrosmose
Die Menge an Bor im Meerwasser variiert von 4 bis 5,5 mg/L, proportional zur Salinität. Es stammt hauptsächlich aus der Einleitung von Kläranlagen, in denen Seifen und Reinigungsmittel verwendet werden, sowie aus landwirtschaftlichen Düngemitteln.
Bor liegt im Wasser als Borsäure H3BO3 und Borat H3BO2- vor. Die vorherrschende Borspezies hängt vom pH-Wert des Wassers ab.
Der pKa-Wert von H3BO3/H3BO2- beträgt 9,2, daher ist das Gleichgewicht normalerweise nach links verschoben, da der Standard-pH-Wert von Meerwasser 8 beträgt.
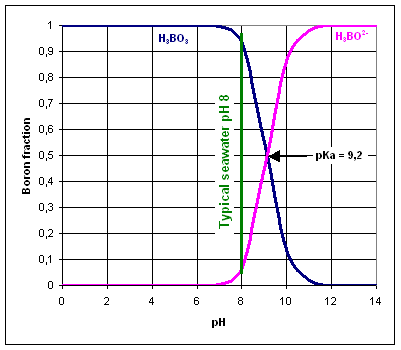
Umkehrosmosemembranen sind sehr effizient bei der Entfernung geladener Spezies wie des Borat-Ions, weniger jedoch bei neutralen Molekülen wie Borsäure.
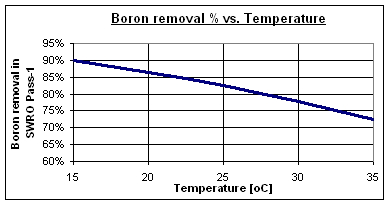
Typische Bor-Entfernungsraten bei pH 8 liegen zwischen 73 und 90 % für Standard-Meerwasser-Umkehrosmosemembranen mit hoher Rückhaltung, abhängig von der Wassertemperatur. Einige spezielle Membranen mit hoher Bor-Entfernung können Werte von bis zu 95 % erreichen.
Normalerweise hat Meerwasser mit hoher Salinität einen hohen Bor-Gehalt und kommt in Gebieten mit sehr warmem Klima vor, wie dem Persischen Golf, dem Roten Meer, dem östlichen Mittelmeer und der Karibik.
Bei 30 °C reduziert sich die Bor-Entfernung auf 78 %, was 1,15 mg/l im Permeatstrom von Schritt 1 entspricht. Daher ist ein spezieller Bor-Entfernungsprozess erforderlich, um die von der WHO geforderten 0,5 mg/l zu erreichen.
Entfernung von Bor aus entsalztem Wasser
Es gibt zwei Hauptverfahren zur Herstellung von Trinkwasser mit weniger als 0,5 mg/L Bor, abhängig von der Salinität des Wassers, der Bor-Konzentration und der Temperatur.
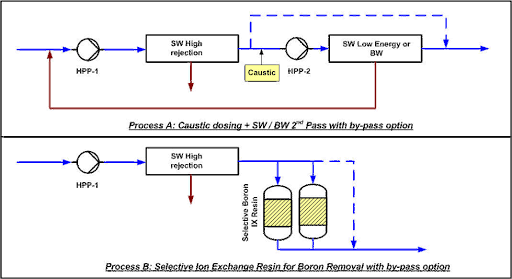
Verfahren A: SWRO in 2 Schritten:
Im Schritt 2 der Umkehrosmose wird Natronlauge zugegeben, um den pH auf 9,5 anzuheben. Ein Teil des Permeats von Schritt 1 kann umgangen werden, um eine bestimmte Menge Mineralien im Wasser zu erhalten. Der zweite Schritt kann aus Niedrigenergie-Meerwassermembranen bestehen, wenn Temperatur und Salinität hoch sind, oder aus Hochrückhalt-Brackwasser-Membranen unter weniger strengen Bedingungen.
Verfahren B: SWRO + IX:
Ein Ionenaustauscherharz wird mit oder ohne Bypass hinzugefügt, abhängig von der Bor-Konzentration und den spezifischen Anforderungen des Behandlungsprozesses. Die notwendige Restbor-Entfernung. Das Harz, das selektiv für Chlor sein muss, wird in-situ mit Natronlauge und Salzsäure regeneriert. Für die kontinuierliche Produktion ist ein Doppelkolonnensystem erforderlich.
Das Bor-Entfernungssystem mittels selektivem Ionenaustausch ermöglicht die Eliminierung von überschüssigem Bor aus jedem Wasser, das in bestimmten Kulturen (hauptsächlich Stein- oder Kernobst) toxische oder schädliche Konzentrationen für die Pflanzung erreichen kann.
Diese Toxizität kann ausgeprägter sein, wenn Abwasser für die Bewässerung oder durch das ehemalige kontaminiertes Grundwasser verwendet wird.
Das Zulaufwasser durchläuft das speziell entwickelte Ionenaustauscherharz zur Entfernung von Bor in wässrigen Lösungen, was zu einem Wasser mit 90 % Bor-Reduktion am Ausgang führt.
Die Austauschkapazität ist begrenzt, und wenn das Harz erschöpft ist, erfolgt die Regeneration.
Die Regeneration der Harze ist vollautomatisch und erfolgt durch das Durchleiten einer spezifischen Säurekonzentration durch das Harzbett, wodurch das zurückgehaltene Bor entfernt wird. Die Regenerationslösung kann gespeichert und später als Abfall entsorgt werden.
Borreiche Abwässer aus Harzen oder Umkehrosmosemembranen können auf Werte konzentriert werden, die eine Rückgewinnung ermöglichen, unter Verwendung von Vakuumverdampfungstechniken. Condorchem – Envitech verfügt über die Kapazität, umfassende Lösungen für diese Anwendung anzubieten.
Zusammenfassung
Bor ist ein hochreaktives chemisches Element, das in der Natur in verschiedenen Verbindungen vorkommt. Es hat vielfältige industrielle Anwendungen und eine wichtige Zukunft, basierend auf dem Aufkommen von Borophen als Nachfolger von Graphen, dessen Eigenschaften es zu einem starken Kandidaten für Nanotechnologie-Anwendungen machen.
Obwohl es für das Pflanzenleben notwendig ist und von Menschen und Tieren gut vertragen wird, gibt es Grenzwerte, die nicht überschritten werden sollten, um schädlich zu werden.
Eine der technischen Lösungen, die seit vielen Jahren zur Bekämpfung von Dürre eingesetzt wird, ist die Entsalzung durch Umkehrosmose, aber das Konzentrat ist reich an diesem Element, und das entsalzene Wasser liegt oft über dem von der WHO festgelegten Grenzwert von 0,5 ppm, was zusätzliche Behandlungen zur weiteren Bor-Trennung erfordert.
Die Optionen bestehen daher darin, das Permeat durch einen zweiten Umkehrosmoseschritt oder durch ein Bett spezifischer Harze zu führen. Im Fall von Harzen wird der Großteil des vorhandenen Bors entfernt.
In beiden Fällen bleibt ein Konzentrat zurück, das nach Konzentration in einem Vakuumverdampfungssystem zurückgewonnen werden kann, bei dem Condorchem – Envitec über nachgewiesene Erfahrung verfügt.
Bibliografische Referenzen und Internetlinks
http://oa.upm.es/155/1/05200006.pdf
https://rua.ua.es/dspace/bitstream/10045/13838/1/Tesis_Chillon.pdfçç