Sections
- Offre de Condorchem Envitech
- Introduction
- Utilisations du lithium
- Métallurgie extractive du lithium
- Précipitation et raffinage du Chlorure de lithium
- Solutions de récupération du lithium
Offre de Condorchem Envitech
Condorchem Envitech propose un ensemble de solutions à haut rendement pour l’extraction et la concentration du lithium. Notre objectif principal est d’offrir une solution compétitive et rentable qui va permette aux exploitations minières de répondre à l’augmentation de la demande de lithium qu’elles ont connue ces dernières années :
Nos solutions pour l’extraction et la concentration du lithium se déclinent selon les procédés suivants :
- Conception d’un procédé personnalisé d’extraction de sel de lithium
- Extraction et épuration physico-chimique des effluents lithium
- Concentration et cristallisation des sels de lithium
- Essais en laboratoire : Bilan matière et efficacités
- Pilotes industriels de démonstration
D’autre part, nous proposons également des solutions complètes pour la récupération du lithium, ainsi que d’autres métaux, dans les processus de recyclage pour tous les types de batteries.
Introduction
Le lithium se trouve dans la nature dans environ 145 minéraux, mais seulement dans quelques-uns, il peut être considéré présent dans des quantités commerciales, en plus de sa présence dans les saumures, les eaux thermales et l’eau de mer, dans des quantités très différentes qui oscillent entre 20 ppm et 65 ppm.
Cet élément peut se trouver sous des formes très diverses, comme dans des concentrations anormales de pegmatites, dans des ambiances sédimentaires associées à l’argile, dans des zones d’altération hydrothermale associées à des minéraux à faibles et à hautes températures, dans des évaporites non marines, dans des saumures d’ambiances désertiques d’eaux salines ou dans des saumures associées à des gisements de pétrole, dans des gisements de bore, béryllium, fluor, manganèse et éventuellement phosphate, dans des ambiances lacustres associées à des silicates de magnésium, dans des eaux, plantes et sols d’ambiances désertiques et dans des roches sédimentaires riches en fer.
À tout ce qui a été énuméré ci-avant, il faut rajouter que les principaux gisements en exploitation, se trouvent dans des pegmatites ou dans des saumures de paléo-dépôts lacustres salins et, dans la plupart des cas, les facteurs de prospection indiquent uniquement la présence de concentrations anormales de lithium, qui n’ont pas rendement économique pour le marché actuel.
Au Chili, le lithium se trouve dans les zones de dépôts salins de la Haute Cordillère et, dans une proportion moindre, dans les champs de nitrates et les gisements salins associés.
Le lithium a diverses applications : Fabrication de batteries pour les ordinateurs, téléphones portables et voitures électriques (dont la demande va beaucoup augmenter avec leur production en masse), produits pharmaceutiques spécifiques pour les problèmes de troubles nerveux (antidépresseurs), purification de l’air ambiant, alliages pour l’aéronautique ( Mg-Li), lubrifiants industriels à base de lithium utilisés dans l’industrie nucléaire comme régulateurs du pH du réfrigérant, obtention de tritium pour les futures générations de réacteurs de fusion nucléaire.
Le carbonate de lithium (Li2CO3) est le composé du lithium le plus utilisé. Un gramme de lithium est contenu dans 5,32 grammes de carbonate de lithium.
Le Chili est le premier producteur mondial de lithium, avec des réserves connues dans le Salar d’Atacama de l’ordre de 4.3 x 106 tonnes. Il s’agit de son principal réservoir et il correspond à 40 % des réserves d’intérêt économique au niveau mondial.
Avec l’arrivée sur le marché de la Société minière Salar de Atacama Ltda., MINSAL, en 1998, le Chili est devenu le premier producteur et exportateur mondial de lithium, en atteignant 30 000 tonnes de concentré, ce qui équivaut à 50% de la demande du marché mondial, des chiffres grâce auxquels la que la Sociedad Chilena del Litio, SCL, lidère les exportations de ce minéral.
Chaque année, uniquement au Japon des travaux sont publiés avec des études d’environ 10 000 nouveaux matériaux, avec des propriétés physiques, chimiques, électriques, magnétiques, ioniques et électrochimiques différentes. De nouveaux produits sont en cours de développement comme le cyanure, l’hydroxyde et le lithium métallique.
Utilisations du lithium
| Utilisations du lithium | |
| Batteries | 35% |
| Céramique, verres, ciments | 32% |
| Graisses lubrifiantes | 9% |
| Air conditionné | 5% |
| Utilisations métallurgiques | 5% |
| Synthèse des polymères | 4% |
| Production primaire d’aluminium | 1% |
| Autres utilisations | 9% |
Les premières utilisations commerciales du lithium ont été dans la métallurgie où il était employé en petites quantités dans des alliages d’aluminium-zinc-lithium et des alliages de plomb, auxquels on rajoutait du lithium pour les durcir.
Entre 1953 et 1959, la Commission de l’énergie atomique des États Unis consomma de grandes quantités d’hydroxyde de lithium pour séparer l’isotope lithium 6, utilisé dans le développement et la production de la bombe d’hydrogène. Depuis 1961, l’utilisation de composés a commencé à se développer, comme le bromure de lithium, sous la forme de saumure concentrée, pour les appareils d’air conditionné par absorption, le carbonate de lithium pour l’industrie de la céramique, le lithium métallique, comme intermédiaire dans la synthèse de produits pharmaceutiques, le n-butyllithium comme catalyseur dans la polymérisation de la fabrication de caoutchouc synthétique.
De nouveaux marchés se développent avec de multiples propos, mais actuellement, le marché le plus important continue à être celui de l’industrie des céramiques qui utilise le carbonate de lithium comme agent fondant dans la préparation de vernis, d’émaux et de verres.
Depuis 1974, l’utilisation du lithium métallique, comme anode dans les batteries primaires, a commencé à indiquer une croissance rapide. Car le lithium est un réactif électro-chimique, en plus de posséder d’autres propriétés uniques.
En 1980, l’industrie de l’aluminium détrôna de la première place la céramique et le verre, comme principal utilisateur en volume de produits au lithium. Le développement des alliages de Li-Al, permettent d’obtenir d’importants progrès dans le développement de nouvelles utilisations, en intégrant les producteurs d’aluminium, de l’aéronautique et de l’armement à la recherche.
Le résultat est l’obtention d’un alliage plus léger, en rajoutant 1,5% au 3 % de Li de l’alliage traditionnel de l’aluminium et qui peut être utilisé dans les composants pour l’aviation commerciale et militaire. En étant 10% plus léger, des économies de combustible sont faites, qui atteignent jusqu’à 20% de la capacité de chargement de l’avion.
Actuellement la consommation du lithium métal, pour ces alliages, est de l’ordre de 45 tonnes par an, c’est à dire 500 000 livres par an de carbonate de lithium. Dernièrement, des pyrocéramiques ont été développées qui trouvent une grande applicabilité dans l’industrie aérospatiale. Car le contenu en lithium de ce type de matériau fait que leurs propriétés d’expansion et de compression soient pratiquement nulles, si le composé se trouve dans des conditions de température extrêmes.
Les États Unis sont toujours le premier producteur de composés à plus grande valeur ajoutée de lithium et le principal consommateur de tout type de matériaux au lithium, avec une consommation de 2 800 tonnes métriques de contenu en lithium en l’an 2000.
Les composés au lithium, outre de satisfaire les besoins de l’industrie primaire de l’aluminium, sont des composants des batteries, de l’air conditionné, des lubrifiants, des systèmes d’humidification, de la production des textiles sophistiqués, des désinfectants pour piscines et salles de bains, et des blanchisseurs dans le nettoyage à sec.
La structure cristalline du lithium se stabilise uniquement à cause des forces électrostatiques d’attraction entre les ions fixes dans les sites du réseau et les électrons libres.
Mais comme il y a peu d’électrons libres, les forces d’attraction qui interagissent ne sont pas très fortes et, par conséquent, le réseau de lithium est faible et facilement déformable, en provoquant ainsi une très faible dureté.
Il possède un point de fusion bas, 180,5 ºC. Cependant, la quantité de chaleur dont il a besoin à cette température pour détruire le réseau et fondre le métal, est extrêmement élevée.
C’est pourquoi le lithium est utile comme absorbant de chaleur, notamment dans les systèmes dont le design requiert un faible poids global, ce qui est très important dans l’industrie comme matériau transporteur de chaleur dans le circuit fermé des réacteurs.
La facilité avec laquelle le lithium cède son électron extérieur, détermine qu’il soit un agent réducteur super puissant et, en tant que tel, il réagisse rapidement avec les agents oxydants moins puissants.
Il réagit, par exemple, avec l’azote à température ambiante pour former le nitrure Li3N, avec l’oxygène de l’air il réagit rapidement en formant l’oxyde Li2O et avec le fluor il génère la réaction la plus violente de tous les éléments. Grâce à ces propriétés, le lithium trouve des applications dans les systèmes de très haute génération d’énergie électrochimique, comme les batteries de lithium-chlore ou de lithium-soufre et plusieurs autres types de piles qui représentent actuellement une industrie en expansion.
Le lithium est composé par la combinaison d’isotopes, 7,4 % de lithium 6 et 92,6 % de lithium 7, ce qui donne un poids atomique isotopique de 6,941. L’isotope 6 a une grande importance, car c’est la matière première pour l’obtention du tritium H, qui avec le deutérium H seraient les combustibles éventuels des réacteurs de fusion nucléaire (Tagger 1983), et on considère que ces réacteurs seront la solution au problème énergétique mondial. Les réactions de la formation du tritium et de la génération d’énergie sont les suivantes:
3Li6 + 0n1 — 2He4 + 1H3 + 4,78 Mev
Les neutrons proviennent à leur tour de la réaction:
1H2 + 1H3 —- 2He4 + 0n1 R + 17,6 Mev
Où NL et NR sont des neutrons lents et rapides. Seuls les neutrons lents peuvent être efficaces pour la conversion du lithium 6 en tritium.
Dans le domaine nucléaire, les réacteurs du type PWR évaluent la possibilité d’utiliser un autre élément à effet neutralisant et régulateur dans le réfrigérant, autre que l’oxyde de lithium.
À cause du prix qui actuellement subi la pression de la demande de lithium du secteur énergétique, l’industrie nucléaire étudie son remplacement par le KOH. La technologie de régulation du pH à travers l’hydroxyde de potassium a déjà été testée dans la technologie nucléaire russe.
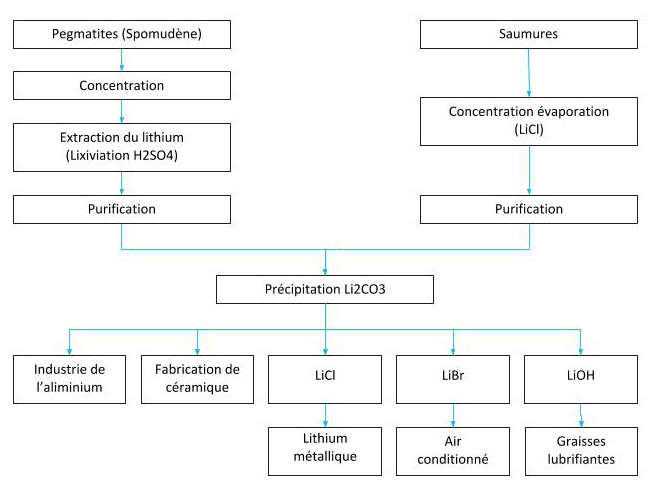
Principaux minerais du Lithium et principaux procédés d’extraction
Métallurgie extractive du lithium
Il est extrait des saumures, où il existe des sels naturels, comme dans le Salar d’Atacama au Chili, le Salar del Hombre Muerto, ainsi que d’autres en Argentine, des dépôts minéraux comme celui de spodumène de Greenbush en Australie ou l’une des plus grandes réserves de lithium trouvées en Bolivie, 21 millions de tonnes métriques dans le Salar bolivien d’Uyuni.
Une grande partie de la production mondiale de lithium provient de saumures, dont le coût de production est bien inférieur à celui des dépôts minéraux (d’après John McNulty $US 1 500-2 300 dollars US/tonne et 4 200-4 500 dollars US/tonne respectivement).
Le lithium s’obtient à partir de deux sources naturelles, du minerai spodumène qui est un double silicate d’aluminium et de lithium (LiAISi2O6) qui se trouve associé au quartz, mica et feldspath. L’autre source d’obtention c’est à partir des saumures naturelles des salars et des geysers, où il se trouve sous la forme de sels de lithium, principalement le sulfate double de lithium et de potassium (KLiSO4).
Le lithium peut être obtenu, comme susmentionné, à partir d’un gisement de silicate double d’aluminium et de lithium (LiAlSi2O6 ou Li2O·Al2O3·4SiO2), dont les contenus sont de 3,73% en Li et 8,03% d’oxyde de Li2O, les autres éléments se trouvant dans un rapport de 51,59% O, 30,18% Si et 64,58% d’oxyde de silice SiO2, 14,5% Al et 27,4% Al2O3.
Le spodumène (le spodumène provient à l’origine de Grèce), également connu en Amérique comme la Kunzita, un cristal d’une dureté de 6,5 à 7, qui présente une densité de 3.1 g/cm3, en outre il possède la caractéristique de présenter diverses couleurs qui vont du gris clair, jaune, vert jusqu’au pourpre.
Les réserves ou les ressources de lithium de Bolivie se trouvent dans des saumures qui ont une densité d’environ 1,2 grammes par litre (g/l), par conséquent une concentration de lithium de 0,1% du poids équivaudrait à 1 000 parties par million (ppm) et 1,2 g/l de concentration de sel de lithium.
L’extraction des saumures de lithium se fait par pompage et la concentration du lithium peut se faire à travers deux procédés.
En premier lieu, par adsorption à travers un adsorbant sélectif du lithium (Polyéthylène glycol) et, en deuxième lieu, à travers l’évaporation dans des piscines peu profondes construites à cet effet. L’évaporation, outre d’élever la concentration des sels, fait que lorsque certaines d’entre elles saturent, un précipité se produise.
L’adsorption présente des avantages, car la composition de l’eau salée n’a pas d’impact sur elle (il peut s’agir de saumures avec des faibles concentrations de lithium, comme cela se produit de manière expérimentale avec l’eau de mer), ni les conditions météorologiques du site et elle ne génère pas beaucoup de déchets.
Les inconvénients sont le besoin de réactifs, le coût élevé de l’équipement d’adsorption, ainsi que celui de l’adsorbant et son aspect compliqué.
Les avantages de l’évaporation naturelle sont l’absence de consommation d’énergie et de nombreux réactifs chimiques. Tandis que ses inconvénients sont le besoin d’utiliser simultanément une autre méthode de séparation, l’accumulation de déchets et la dépendance des conditions météorologiques du site (vitesse d’évaporation et pluies). Après le choix de cette dernière méthode pour le Salar d’Uyuni (avec laquelle fonctionnera le site pilote déjà installé), nous ne ferons qu’une brève description de celui-ci.
La plus grande production mondiale de lithium provient des saumures du Salar d’Atacama au Chili, où est utilisée la méthode d’évaporation et dont on dispose de données et de nombreux facteurs de fonctionnement qui permettent sa comparaison avec ceux du Salar d’Uyuni.
Les saumures d’Atacama sont plus riches en lithium que ceux d’Uyuni (également en potassium et bore), par conséquent le rapport Mg/Li, nocif pour la concentration du lithium est de 6/1 et 19/1 respectivement.
Tandis que l’évaporation et la pluviométrie sont de 3 200 mm/an et 10-15 mm/an à Atacama, à Uyuni elles sont de 1 500 mm/an et 200-500 mm/an. Ainsi, nous pouvons dire qu’à Uyuni, l’évaporation est inférieure et la pluie bien supérieure, ce qui retardera assez l’évaporation.
À Atacama le procédé d’évaporation qui concentre le lithium de 0,15% à 6% (40 fois) dure entre 12 y 18 mois. C’est pourquoi on peut prévoir qu’à Uyuni l’évaporation dure beaucoup plus longtemps, notamment avec des pluies intenses comme celles qui se sont produites dernièrement qui ont inondé les piscines d’évaporation du site pilote.
| Principaux minerais du lithium | ||
| Minerai | % Li max. | % Li commercial |
| Amblygonite | 4.73 | 3.7-4.2 |
| Eucryptite | 5.50 | 2.6-3.0 |
| Lépidolite | Variable | 1.4-1.9 |
| Pétalite | 2.26 | 1.4-2.2 |
| Spodumène | 3.73 | 2.6-3.0 |
| Contenu moyen de lithium dans les saumures exploitées | ||||||||
| Localisation | % Li | % Na | % K | % Mg | % SO4 | % Cl | % B | Li/Mg |
| Bolivie : salar d’Uyuni | 0.025 | 8.80 | 0.72 | 0.65 | 0.046 | 15.7 | 0.02 | 1/19 |
| Chili : salar d’Atacama | 0.14 | 7.6 | 1.87 | 0.93 | 0.03 | 16 | 0.1 | 1/1.64 |
| Israël-Jordanie : Mer Morte | 0.0015 | 3.21 | 0.60 | 3.33 | 1.18 | 17.32 | 0.003 | 1/2200 |
| USA: Great Salt Lake, Utah | 0.004 | 8.0 | 0.65 | 1.00 | 0.016 | 14.0 | 0.006 | 1/250 |
| Silver peale, NV. | 0.023 | 6.2 | 0.53 | 0.033 | 0.20 | 10.06 | 0.008 | 1/1.5 |
À titre d’exemple, avec les saumures obtenues du Salar d’Atacama jusqu’à 1997 seul du carbonate de lithium a été produit, en intégrant en plus à partir de 1998, le chlorure de lithium dans son procédé de production.
L’obtention du carbonate, à partir de ces saumures pourrait se résumer en deux étapes : Concentration des solutions, à travers des bassins d’évaporation solaire : Les contenus initiaux des saumures du Salar d’Atacama sont d’environ 0,17 % en Li, en parvenant à se concentrer des valeurs allant jusqu’à 4,3 % à 5,8% Li.
Traitement de la saumure concentrée dans une usine chimique : Pour la production du Li2CO3 (99,5% de pureté), les saumures concentrées sont purifiées et cristallisées, puis se fait le procédé de carbonatation, une précipitation postérieure et, en dernier, le séchage des cristaux.
Le procédé appliqué par la Sociedad Chilena de Litio (SCL), qui appartient à Foote Míneral Co., filiale de Cyprus Amax Minerals Co, pour la récupération du lithium a été développé par cette entreprise dans son usine de Silver Peak, Nevada (USA), mais en l’adaptant aux caractéristiques de ces saumures.
La production de Chemetall Foote, couvre la demande nécessaire à la production de composés au lithium à plus grande valeur ajoutée, de ses usines chimiques situées aux États Unis, et elle fournit en plus ses filiales Chemetall en Allemagne et Taïwan.
Précipitation et raffinage du Chlorure de lithium
L’étude en laboratoire « Traitement chimique des saumures du Salar d’Uyuni-Potosí » réalisée en 1987, en France, à travers l’Accord UMSA-ORSTOM (Office de la recherche scientifique et technique outre-mer, organisme aujourd’hui remplacé par l’IRD, Institut de recherche pour le développement), en simulant dans 5 récipients les conditions des piscines d’évaporation, établit que le chlorure de sodium (NaCl) se précipite en premier et presque tout de suite après le chlorure de potassium (KCl).
Comme le chlorure de magnésium (MgCl2) ne peut pas être séparé par l’évaporation, ce qui complique le procédé, il est précipité en hydroxyde de magnésium (Mg(OH)2) en rajoutant de la chaux.
Le chlorure de lithium bien concentré dans les 5 récipients a été lavé avec de l’hydroxyde de sodium, afin d’éliminer les éventuelles traces de magnésium et de calcium restantes, pour finalement le précipiter en Cl-en utilisant du carbonate de sodium. La récupération moyenne du lithium a été de 80,8% et la pureté moyenne du Cl- 94,4%.
Trois tests en laboratoire ont été faits récemment avec 25 litres de saumure du Salar d’Uyuni avec 0,107% de lithium, dans le National Institute of Advanced Industrial Science and Technology du Japon, pour l’obtention de lithium par la méthode de l’adsorption. Ils ont donné du Cl- avec une pureté supérieure à 99,8% et une récupération moyenne de 73%.
Cette méthode est employée dans le Salar del Hombre Muerto, en Argentine, qui contient 0,06% de lithium.
Le Cl- obtenu, quelle que soit la méthode, doit être purifié, séché et cristallisé. Malgré le haut contenu en lithium du Salar d’Atacama et l’expérience dans son obtention, on indique que sa récupération est de 42%.
Le Cl- à utiliser dans la fabrication de batteries pour les véhicules électriques doit avoir une pureté d’au moins 99,95%. C’est pourquoi le Cl- obtenu par précipitation doit être raffiné à travers plusieurs réactions et étapes de recristallisation, dans certains cas à travers une résine d’échange ionique.
Comme le procédé de raffinage a un coût et que sa récupération est inférieure après chaque étape (dans l’étape de raffinage elle est estimée à environ 70%), plus la pureté du Cl- sera grande, plus son prix augmentera dans une proportion bien supérieure.
Bien que la méthode décrite pour l’obtention du Cl- paraisse simple, comme tout procédé industriel, elle requiert une technologie et logistique appropriées, des techniciens expérimentés et du personnel bien formé.
L’évaluation du fonctionnement du site pilote permettra de confirmer ou de changer le procédé de concentration du lithium à travers des piscines d’évaporation.
| Solubilités du Li2CO3 et du LiCl dans g/100g H2O | ||||||||||||
| Temp. ºC | 0 | 5 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 100 |
| Li2CO3 | 1.52 | – | 1.41 | 1.31 | – | 1.24 | 1.16 | 1.07 | 1.00 | – | 0.84 | 0.70 |
| LiCl2 · 2H2O | 40.9 | 42 | 42.7 | – | – | – | – | – | – | – | – | – |
| LiCl2 * H2O | – | – | – | – | 45.85 | 46.3 | 47.3 | 48.3 | 49.6 | 51.1 | 52.8 | 56.511 |
| Source: Linke & Siedell, 1965 1Hutting and Steudemann, 1927 **Relevés par Kraus and Burgess, 1929 ; densité de la sol. saturée 1,017 à 0 °C et 1,014 à 15 °C. | ||||||||||||
Exemple 1. Processus de traitement des saumures riches en Li à Atacama (Chili)
Le carbonate de lithium, est le composé de base le plus important parmi les sels de Li, sa demande représente 60% des produits au Li.
Son importance se fonde essentiellement sur le fait qu’il est facile à purifier et qu’il sert à la conversion d’autres sels de lithium inorganiques et organiques comme le Li2CO3, LiBr et LiOH.H2O et d’autres composés.
On estime que la production mondiale est de 45 000 tonnes par an, le Chili étant le principal producteur, tandis que le principal consommateur de carbonate de lithium ce sont les États Unis.
L’extraction des saumures du Salar d’Atacama a été faite par la Sociedad Chilena del Litio, depuis 1984, qui dispose d’un site d’une capacité de production de 11 800 tonnes par an de Li2CO3.
L’extraction des saumures du Salar, Figure Nº7, se fait à travers des pompes qui aspirent la saumure à 30 m de profondeur, en la déchargeant à travers des tuyauteries dans un système de bassins d’évaporation solaire, où le Li se concentre à partir de 0,17% jusqu’à 4,3%.
La construction des bassins dans le salar, s’est faite en brisant la croûte saline et en laissant une surface plane sur laquelle s’étend une couche d’argile. À la fois les digues et le fond des premiers bassins d’évaporation seront recouverts d’un plastique résistant de 0,5 mm d’épaisseur.
La protection de polyuréthane s’obtient avec une couche de sels de NaCl d’environ 30 cm d’épaisseur. Pendant le procédé d’évaporation, les sels se précipitent dans les bassins de manière séquentielle, ceux qui ont été ramassés et rejetés comme impuretés sont : halite (NaCl), sylvinite (NaCl + KCI), carnallite (KMgCl3 6H2O) et bischofite (MgCl2.6H2O).
Dans les bassins de plus grande concentration se précipite la carnallite de lithium. (LiCl.MgCl2.7H2O), dans le but de récupérer le lithium qu’elle contient, elle est repulpée et lavée avec une solution saturée en chlorure de magnésium, mais pas saturée en chlorure de lithium.
La bischofite (MgCl2. 6H2O) présente et non dissoute est séparée par centrifugation et elle est éliminée du système. La saumure finalement ainsi concentrée atteint 5,8% Li, 20% Mg et 0,7% B exprimée en acide borique (H3BO3), et elle est prête à être transportée vers l’usine chimique située à Antofagasta à 170 km du Salar d’Atacama.
Le traitement chimique dans l’usine de La Negra consiste à éliminer le magnésium restant, en deux étapes de purification, come carbonate et hydroxyde de magnésium, respectivement.
Pour cela, la saumure concentrée est diluée jusqu’à un contenu de 0,6% de Li, avec de l’eau mère provenant de l’étape finale de précipitation du carbonate de lithium.
Ce produit s’obtient par réaction à chaud (autour de 85ºC), entre la saumure purifiée libre de magnésium (1ppm) et une solution de Na2CO3, en précipitant le Li2CO3. Le produit final est séché et il est commercialisé en cristaux (70%), ou bien il est compacté pour être vendu sous la forme de granules (30%).
La pureté du produit est proche de 99,5% Li2CO3. Cependant, son contenu en bore (400-600 ppm) empêche son utilisation comme matière première pour la fabrication de lithium métal, via le chlorure de lithium.
2LiCl + Na2CO3 == Li2C03 + 2NaCl
Afin de résoudre le problème susmentionné et pouvoir obtenir un carbonate de lithium avec les spécifications exigées par le marché, FOOTE a conçu un procédé qui permet d’éliminer le bore de la saumure, à travers l’extraction par un solvant, dans une étape précédant la séparation du magnésium restant.
L’unité d’extraction liquide-liquide, sépare premièrement le bore restant de la saumure concentrée provenant du salar, puis ensuite continue avec le procédé décrit ci-avant. Finalement, on obtient un produit final de carbonate de lithium avec de très faibles contenus en bore (inférieurs à 5 ppm).
Dans une première étape, la plus grande partie de magnésium est lessivée, le procédé conduit à la formation d’une solution de chlorure de lithium à faible contenu en sulfate. Finalement il est traité avec du carbonate de sodium, pour obtenir du carbonate de lithium.
En 1998, MINSAL estima une production de 9 000 tonnes de Li2CO3 avec une capacité autour de 20 000 tonnes/an. Cette compagnie a envisagé l’expansion, pour construire une usine de n-butyllithium au Texas et faciliter ainsi la production de matériaux pour les batteries.
Le procédé développé par MINSAL, est très différent, dans ses premières étapes, à celui utilisé par SCL. Car il envisage l’utilisation en tant que matière première des sels ramassés dans les bassins qui contenaient du sulfate de lithium.
En 1997, SQM, leader dans la commercialisation de salpêtre, démarra la commercialisation et la production de carbonate de lithium, à partir des saumures du Salar d’Atacama.
Une fraction de la saumure provenant du procédé d’évaporation solaire pour la production de chlorure de potassium, continue son procédé de concentration, en devenant une source de lithium à partir duquel SQM produit le carbonate de lithium dans une usine située dans le Salar del Carmen.
La saumure concentrée en lithium est transportée dans des camions à partir du Salar d’Atacama jusqu’à l’usine, où elle est purifiée pour en extraire d’abord son contenu restant de bore, puis de magnésium à travers des procédés d’extraction et de filtration.
Finalement, la saumure purifiée de lithium réagit avec le carbonate de sodium, pour produire le carbonate de lithium qui est filtré, lavé, séché et conditionné dans différents formats de produits qui vont depuis les produits finis, comme ceux utilisés dans l’industrie des batteries rechargeables d’ion lithium, jusqu’aux produits granuleux qui sont utilisés dans le procédé de production de l’aluminium.
Les deux compagnies, SQM et FMC (SCL), transportent les saumures concentrées du salar jusqu’à leurs usines situées à Antofagasta et couvrent pratiquement tout le marché américain (88% du lithium importé par les États Unis provient du Chili, 7,5% d’Argentine et le reste ceux sont de petites quantités de Chine et du Japon.
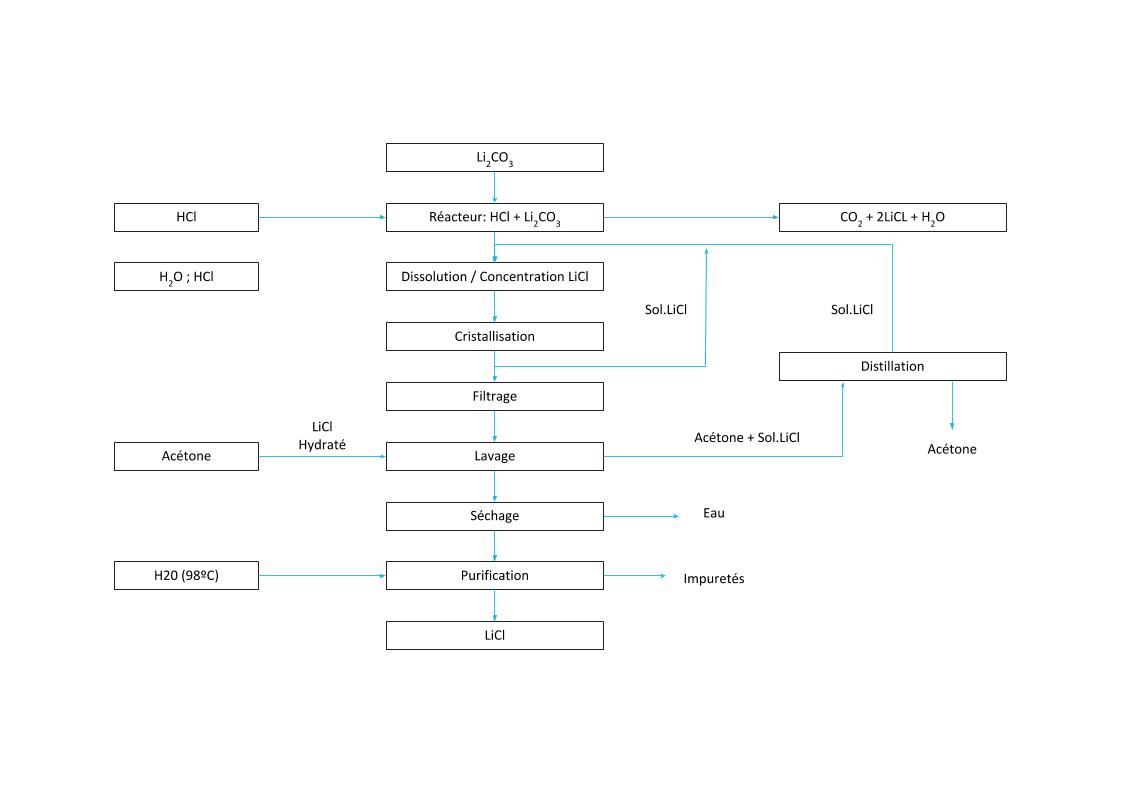
Le procédé d’obtention du chlorure de lithium, à partir du carbonate ou d’hydroxyde de lithium, peut se faire par réaction avec de l’acide chlorhydrique:
Li2CO3 + 2HCl === 2LiCl + H20 + C02
LiOH·H2O + HCl === LiCl + 2 H2O
Pour éliminer le sulfate et le calcium, contenus dans la saumure de carbonate, il faut rajouter de l’acide oxalique et du chlorure de baryum au réacteur. Ensuite, la saumure est filtrée pour éliminer ses impuretés.
À continuation, le système passe à l’étape de cristallisation, centrifugation et séchage. Le chlorure de lithium cristallisé est lavé avec de l’eau froide en contre-courant, puis tamisé.
À partir du LiCl, il est possible d’obtenir du Li métallique, qui est utile dans les alliages de Li-Al et dans les batteries primaires (sources d’énergie).
L’un des avantages de cet élément c’est qu’il chauffe jusqu’à 600ºC sans qu’il se décompose. En étant chauffé à 800ºC en atmosphère hydrogène, il se décompose partiellement en oxyde de lithium et gaz carbonique, composé peu soluble.
PROCESSUS DE CRISTALLISATION LiCl
Processus chimique sans évaporation naturelle
PROCESSUS DE CRISTALLISATION DU LITHIUM (2)
Exemple 2. Procédé différentiel d’obtention du LiCl
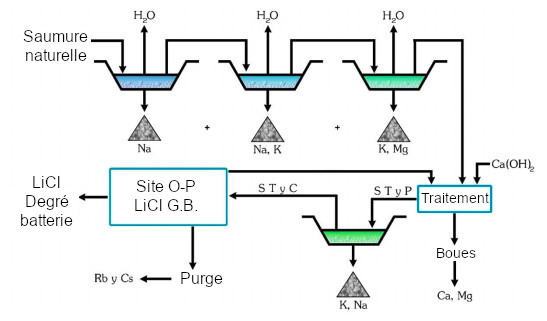
Dans une succession de bassins d’évaporation séquentielle, comme indiqué dans le diagramme ci-avant, les chlorures de sodium, sodium et potassium, potassium et magnésium se précipitent à cause de la solubilité différentielle.
Une fois atteinte une concentration d’environ 6% de LiCl, on rajoute de la chaux pour précipiter le magnésium et on peut éliminer le bore comme éther d’alcool isopropylique par extraction par des solvants, avec leur récupération par distillation.
D. Galli a décrit ces procédés en détail dans le brevet de l’entreprise ADI qui correspond à l’exploitation du salar de Rincón en Salta.
Schéma des bassins dans le procédé évaporitique. Source Dr. D. Galli.
Après avoir rajouté la chaux, on sépare le Mg, Ca et B et le procédé peut suivre plusieurs alternatives, selon la composition du lithium que l’on souhaite obtenir : en rajoutant de la soude Solvay le carbonate de lithium impur se précipite et, ensuite, par injection de CO2 devient du bicarbonate de lithium, qui par filtration et réchauffement permet d’obtenir du Li2CO3 degré batterie.
De manière alternative, par électrodialyse de la solution concentrée de chlorure de lithium, on peut obtenir du LiOH.H2O et du LiCl d’une grande pureté. L’entreprise Simbol a développé une méthode qu’elle a breveté pour la purification du LiOH par électrodialyse du LiCl afin d’obtenir un niveau batterie.
De manière alternative, au procédé susmentionné, la saumure peut être traitée dans des colonnes de résines d’échange qui séparent les polluants, pour ensuite rajouter la soude Solvay, afin d’obtenir du carbonate de lithium d’une grande pureté. Il faut signaler que l’élution et la régénération des colonnes implique la formation de grands volumens de déchets liquides.
Le procédé de rajout de chaux et soude (soda-lime) permet l’élimination du Mg2+ y SO42– par précipitation du sulfate de Mg et du Ca qui représentent des boues polluantes, bien qu’elles puissent être utilisées pour consolider les chemins dans le développement du salar ou bien comme matériau Lithium. Une ressource naturelle stratégique ignifuge de remplissage pour le bâtiment. Le bore doit être éliminé, à cause de son effet négatif dans l’obtention de lithium métallique. C’est pourquoi on procède à l’extraction avec des solvants comme l’alcool isopropylique qui forme des esters.
Avec la méthode chaux sodée on obtient du Li2CO3 degré technique (> 99,5%) qui peut être redissout comme bicarbonate soluble, LiHCO3, lorsque le CO2 fait des bulles, filtrer et, à travers l’augmentation de la température, éliminer le CO2 et précipiter le carbonate de lithium degré batterie (>99,9%), avec recyclage du CO2.
Il est important de signaler que ce procédé pourrait être mis en place comme fixateur du dioxyde de carbone atmosphérique, en gagnant ainsi des fertilisants verts. Le chlorure de lithium peut être conduit à une grande pureté, par redissolution dans de l’isopropanol qui doit être distillé pour récupérer le solvant.
Le carbonate de lithium peut également se dissoudre dans du HCl et être traité dans des colonnes d’échange ionique, afin d’obtenir du LiCl d’une grande pureté. Finalement, le lithium métallique s’obtient par électrolyse d’un mélange eutectique fondu de KCl-LiCl à environ 400ºC sous atmosphère d’argon.
L’utilisation de solvants, plus chers que l’eau, est coûteuse, c’est pourquoi il faut les récupérer par distillation, ce qui augmente les coûts d’énergie. Il faut donc bien évaluer son incidence sans le coût du produit final.
Des salars à haut contenu en Mg comme Atacama et Uyuni présentent un problème dû à la floculation de l’hydroxyde de magnésium, pendant la précipitation avec la chaux.
Dans ces cas, il faut éliminer au préalable le magnésium par précipitation avec du Ca(OH)2 avant l’tape de concentration par évaporation sous les rayons solaires. Dans les salars à haut contenu en magnésium, on préfère la voie des sulfates, au lieu des chlorures.
Exemple 3. Récupération sélective du lithium(LiOH)
La récupération sélective du lithium à partir de saumures avec un contenu inférieur à 1%, en présence de hautes concentrations d’autres ions alcalins et alcalino-terreux, est un objectif industriel.
Les procédés évaporitiques se fondent sur la solubilité différentielle des sels de lithium, dans des solutions concentrées des saumures, c’est à dire la recristallisation fractionnée.
De manière alternative, des procédés chimiques et électrochimiques sélectifs ont été conçus, face à la récupération du chlorure, hydroxyde ou carbonate de lithium de grande pureté qui cherchent à réduire les temps du procédé et à réduire l’impact environnemental dû à la perte d’eau et à la formation de déchets environnementaux nocifs.
Une méthode rapide a été proposée récemment, fondée sur la précipitation du phosphate de lithium, Li3PO4 peu soluble (0,39 g/l) par le traitement des saumures avec de l’acide phosphorique, puis traitement du phosphate de lithium insoluble avec de la chaux, pour former de l’hydroxyapatite très insoluble et récupérer l’hydroxyde de lithium soluble.
3Li3PO4 + 5Ca(OH)2 -> Ca5(PO4)3OH + 9LiOH
Processus d’extraction du lithium de ses dépôts dans les salars argentins. Dans ce procédé, l’acide phosphorique est récupéré par traitement de l’hydroxyapatite avec de l’acide sulfurique, avec formation de sulfate de calcium hydraté (plâtre) qui a des applications dans le bâtiment:
Ca5(PO4)3OH + 5H2SO4 -> 5CaSO42H2O + H3PO4
Cette méthode a été brevetée par l’entreprise de sidérurgie coréenne Posco qui a installé une usine pilote à Cachauri, Jujuy, en 2015. La méthode ne traite pas les saumures par évaporation, ce qui est donc significativement plus rapide que les méthodes évaporitiques.
Cependant, comme elle utilise de l’acide phosphorique qui lui est bien récupéré, elle peut laisser des déchets de phosphates de magnésium et de calcium sous forme de boues polluantes.
Méthodes d’adsorption
L’adsorption sélective du lithium contenu dans des saumures (300-1000 ppm) et l’eau de mer (0.125 ppm) en utilisant des absorbants comme le MnO2, TiO2, l’hydroxyde d’aluminium, etc. a été largement étudiée. La captation du lithium dans ces systèmes dépend de l’intercalage des ions lithium dans des réseaux non stœchiométriques de ces oxydes avec une capacité qui varie selon le type d’adsorbants entre 3-35 mg/g.
Lorsqu’on extrait des solutions riches en ions lithium, comme les saumures (> 5 mg/L) on peut parvenir à des captations > 20 mg/g. Dans certains cas, il existe co-insertion d’autres ions présents dans les saumures comme le Mg, Na, K, Ca, etc.
L’oxyde de manganèse a été étudié comme adsorbant, dans plusieurs modèles comme les tamis ioniques de MnOx avec récupération postérieure du lithium par lixiviation à l’acide, pour donner par exemple Li0.15H0.76Mg0.40MnIII0.08MnIV1.59 O4.
L’oxyde de structure cubique spinelle -MnO2 peut intégrer 38 mg/g pour donner LiMn2O4 par intercalage dans le réseau cubique.
Cette alternative a été évaluée par des chercheurs coréens à Uyuni (Bolivie). Cependant, la stabilité de l’oxyde dans des colonnes de lixiviat n’a pas été suffisante pour le procédé à l’échelle industrielle.
Par traitement acide qui remplace l’ion lithium par des protons à structure cristalline pendant l’élution, se produit la dissolution de l’oxyde mixte et l’élution d’autres ions comme le Ca2+, Mg2+, etc.
Une attention particulière a été apportée aux roches qui peuvent capter le lithium dans la croûte terrestre, comme les systèmes modèle pour l’adsorption et absorption du lithium dans ses structures.
Par exemple la gibbsite, un minerai de l’hydroxyde d’aluminium, a été étudiée de manière détaillée pour la captation du lithium. Plusieurs entreprises ont breveté des méthodes de récupération du lithium, en utilisant diverses formes d’hydroxyde d’aluminium amorphe, parmi elles Dow Chemical Co., FMC (Foot Mineral Company), Simbol Inc., Posco, etc.
FMC, qui opère en Argentine, dans le Salar del Hombre Muerto (Catamarca), à travers sa filiale Minera del Altiplano SA, utilise une méthode avec une technologie propre, fondée sur l’échange ionique avec les zéolites, probablement du type gibbsite, contrôlé par température.
Dans ces méthodes, les ions lithium sont extraits des saumures concentrées qui contiennent du LiCl, après une préconcentration à 9 g/L, en général par évaporation solaire. Ensuite le liquide circule à travers une colonne d’hydroxyde d’aluminium hydraté polycristallin, soutenues dans un matériau aggloméré jusqu’à saturation du lithium.
Dans une deuxième étape, le LiCl de l’échangeur ionique, se déplace, avec une solution concentrée de NaCl, de manière répétée et, finalement, avec une solution diluée de LiOH.
Résines d’échange ionique comme les Zeo-karb 225, Dia-ion, SK, AG50WX8, avec des groupes sulfonates et des agents chélatants ont été utilisés pour capter le lithium des saumures synthétiques.
L’extraction avec des solvants organiques de lithium attrapé avec des agents organiques, a également été proposée. Dans ces cas, le coût des résines, l’énergie qu’implique sa régénération, le coût des solvants et l’éventuel impact environnemental dû aux effluents, sont critiques.
Méthodes électrochimiques
Parmi les méthodes d’extraction du lithium des saumures avec un faible impact dû à la perte d’eau par évaporation et sans altération environnementale due aux déchets chimiques, comme le NaCl ou le MgSO4, tout en ayant pas un coût excessif se trouvent les méthodes électrochimiques.
Kanoh informa de l’intercalage d’ions lithium dans des cathodes d’λ-MnO2, en utilisant une cellule électrochimique avec anode de platine et il étudia la cinétique de l’insertion/extraction ionique λ-MnO2/LiMn2O4 au contact avec des solutions de LiCl.
L’inconvénient de cette cellule est la réaction dans l’anode qui modifie le pH de la saumure par décomposition de l’eau. La Mantia et des collaborateurs utilisèrent des cellules entropiques pour extraire le lithium en utilisant des électrodes de type batterie cathode de LiFePO4 et anode Ag/AgCl, sans changements de pH dans la saumure, mais avec un coût élevé pour l’argent et la dissolution dans des solutions très concentrées en chlorure.
Plus récemment, ces auteurs ont introduit une anode de nickel hexacyanoferrate qui échange des cations, comme alternative à l’électrode d’Ag/AgCl. Une cellule électrochimique similaire combinée λ-MnO2 avec anode d’Ag est rapportée par Lee, pour extraire le lithium des saumures artificielles.
Kim utilisa, à son tour, la même cathode d’oxyde de manganèse combinée à une électrode capacitive de carbone, dans en une configuration de supercondensateur.
Ces configurations ont été analysées récemment par Missoni. Méthodes similaires Hautement sélectifs au lithium, par rapport au sodium, elles emploient un procédé électrochimique avec une cathode de type batterie de la structure olivine LiFePO4, recouverte de dopamine avec I- /I3 – .
Hoshino proposa l’électrodialyse avec une membrane de liquide ionique, mais à très faible vitesse d’extraction.
La méthode proposée par Liu, avec deux électrodes de LiFePO4 et FePO4 séparées par une membrane perméable aux anions pour l’extractions du lithium des saumures, mérite un commentaire.
Les ions lithium produits dans le LiFePO4 se combinent aux anions X- en augmentant la concentration de LiX, tandis que dans l’électrode FePO4 les ions lithium s’intercalent en réduisant la concentration de LiX dans ce compartiment.
Dans les procédés d’extraction de lithium des dépôts de salars argentins, les chercheurs argentins d’INQUIMAE ont développé une méthode alternative d’extraction du lithium à partir de saumures naturelles de la Puna, qui a été brevetée par le CONICET.
Cette méthode électrochimique est rapide, elle présente un faible impact environnemental, parce qu’il n’y a pas d’agrégation de substances chimiques, elle ne produit pas de déchets, elle a un faible coût énergétique et elle est hautement sélective à l’extraction de LiCl.
Un test du concept a été réalisé et actuellement l’ingénierie est en cours, pour le développement et l’escalade des réacteurs. La saumure circule à travers une cellule électrochimique, non divisée par une membrane, qui utilise comme cathode un oxyde de lithium et du manganèse de type batterie Li1-XMn2O4 (LMO) (0 x 1) qui capte sélectivement le Li+ par intercalage dans le solide, et le polymère polypyrrole (PPy) comme anode qui capte sélectivement les ions Cl- par compensation de la charge, en oxydant cette électrode pseudocapacitive.
En premier lieu, la saumure est exposée aux électrodes de Li1-xMn2O4 réduit et PPy oxydée, et le LiCl est capté spontanément avec génération d’énergie.
Après le rinçage des électrodes, la saumure est remplacée par un électrolyte dilué et la polarité de la cellule est inversée, en récupérant ainsi le LiCl en solution.
Avec une différence de potentiel de moins de 1 V, les ions Li+ sont intercalés dans le Li1-XMn2O4 et les ions Cl- s’adsorbent dans le PPy oxydé.
L’énergie nécessaire pour le deuxième procédé et pour les pompes d’extraction et de circulation peut être obtenue de panneaux solaires, dans la région de la Puna, avec un rayonnement solaire de plus de 2.600 kWh/m2 pendant toute l’année, ce qui en fait une des meilleures régions de la planète pour la récolte d’énergie solaire.
L’investissement de capital pour des panneaux solaires d’une durée de vie utile de 30 ans a été évaluée pour seulement 10 dollars, par tonne de chlorure de lithium extrait.
Pendant la captation du LiCl, seul les ions Li+ sont intercalés sélectivement dans l’oxyde de manganèse au contact avec la saumure hautement concentrée qui contient du sodium, du potassium, du magnésium, etc.
Le spinelle LiMn2O4 est une phase stable avec la moitié du contenu de lithium lors de la décharge à partir de λ-MnO2 a Li2Mn2O4. Le Li2Mn2O4 a une structure cubique spinelle (groupe spatial Fd3m) et une cellule cristalline unitaire qui contient 56 atomes : Une structure empaquetée d’ions oxygène dans 32 sites avec 16 Mn dans des sites octaédriques (MnO6) et 6 lithiums dans des sites tétraédriques 8a.
L’insertion et l’extraction d’ions Li+ a lieu à travers un procédé topotactique dans la structure cubique avec expansion isotropique, comme le révèle le courant de réflexions par diffractométrie de rayons X.
À travers une électrode sélectif d’ions chlorures, il est possible d’extraire du chlorure de lithium des saumures avec une haute sélectivité, en ajustant le potentiel redox du système MnIII/MnIV dans la structure cristalline.
À cause de l’existence de deux types de sites tétraédriques, non équivalents pour le Li+ dans le spinelle, on observe deux procédés d’oxydation-réduction dans ce matériau d’électrode positive dans les batteries.
Le procédé d’extraction du chlorure de lithium de la saumure est hautement sélectif et efficace, dans la stœchiométrie LiMn2O4/λ-MnO2 avec une haute reproductibilité, plus de 200 cycles de charge et décharge, faible consommation d’eau, faible consommation énergétique 5 Wh/mol fondé sur la charge et 10 Wh/mol fondé sur la concentration de lithium récupéré.
Aucune co-insertion d’ions sodium ou magnésium n’a été observée, dans l’oxyde de manganèse, par mise en évidence par diffraction de rayons X.
Actuellement, l’ingénierie approfondie et d’escalade des réacteurs électrochimiques, est en cours de développement, pour l’extraction du lithium à partir des saumures naturelles, à travers cette méthode [32].
Le LiMn2O4 a une capacité de captation du lithium de 38 mg/g. Comme c’est un métal plus léger que le lithium, il peut stocker beaucoup de charge par unité de masse.
Cependant, lorsqu’il n’est pas récupéré à travers un moyen électrochimique, il faut beaucoup de charge : 7 g de lithium requièrent une charge de 1 Faraday, soit 26,8 Ah. Ce qui a donné lieu au « paradoxe du lithium » à travers des procédés d’extraction du lithium de ses dépôts dans les salars argentins. Ce qui est essentiel, c’est la conception soignée du réacteur avec des électrodes tridimensionnelles à grand espace spécifique.
Solutions de récupération du lithium
Nos solutions pour aider l’extraction du lithium à partir du spodumène sont :
- Solution 1. Concentration de la solution de Li2SO4
- Solution 2. Purification de Li2CO3
- Solution 3. Récupération de Na2SO4 en tant que sous-produit lors de la production de Li2CO3.< /li>
- Solution 4. Production de LiOH par réaction de Li2CO3 avec de la chaux
- Solution 5. Production de LiOH par électrodialyse
- Solution 6. Production de LiCl
- Solution 7. Traitement de l’eau contaminée (résidus).
Solution 1. Concentration de la solution de Li2SO4
Le procédé à l’acide sulfurique pour l’extraction du lithium implique normalement :
- Procédé de chauffage à 1 100 °C dans un four rotatif (l’α-spodumène est converti en β-spodumène)
- Le β-spodumène est broyé, mélangé et torréfié avec H2SO4 à 250 ºC.
- A ce stade, Li2SO4 (soluble dans l’eau) est généré et un résidu de minerai insoluble
- L’excès de H2SO4 est neutralisé avec CaCO3. Le four est ensuite lessivé avec de l’eau
- Filtration pour l’élimination des impuretés
- Ajout de chaux pour précipiter le magnésium et de carbonate de sodium pour précipiter le calcium résiduel
- Ajustement du pH avec H2SO4 et Li2SO4 concentration de la solution par multiple-e effet évaporation (triple effet) [1]. Une solution contenant du lithium très concentrée est nécessaire
- Finalement, le lithium peut être précipité sous forme de Li2CO3 par addition de carbonate de soude. Après cristallisation, du carbonate de lithium de qualité technique est produit.
L’utilisation de l’évaporation à effets multiples peut aider le processus de concentration du lithium avant la précipitation du carbonate de lithium
Solution 2 : Épuration du Li2CO3
Le carbonate de lithium de qualité technique est redissous pour éliminer les impuretés. Par recristallisation, du carbonate de lithium de qualité batterie peut être produit.
L’utilisation des technologies de cristallisation peut faciliter la production de carbonate de lithium de qualité batterie
Solution 3 : Récupération de Na2SO4 en tant que sous-produit du lithium
Production de carbonate :
- Na2CO3 est ajouté à une solution concentrée de Li2SO4 afin de précipiter le carbonate de lithium
- Par évaporation et cristallisation, on obtient du carbonate de lithium
- Une solution résiduelle contenant du sulfate de sodium peut éventuellement être concentrée dans un cristalliseur pour la récupération de Na2SO4 (sous-produit).
L’utilisation de la technologie d’évaporation-cristallisation peut faciliter la récupération du sulfate de sodium (sous-produit).
Solution 4. Production de LiOH par réaction de Li2CO3 avec Ca(OH)2
Li2CO3 + Ca(OH)2 –> 2LiOH + CaCO3
Un LiOH monohydraté peut être produit par évaporation-cristallisation.
L’utilisation des technologies de cristallisation fournies par Condorchem Envitech peut aider lors de la production de LiOH à partir de Li2CO3.
Solution 5. Production de LiOH par électrodialyse
Lors du traitement par électrodialyse (ED) d’une solution de Li2SO4, la chambre cathodique est enrichie en LiOH tandis que celle de l’anode est enrichie en H2SO4.
Cependant, d’autres métaux alcalins comme le sodium et le potassium seront également enrichis dans la chambre cathodique. Cela pourrait être résolu en mettant en œuvre un processus de cristallisation suivant ED.
La solubilité de NaOH et KOH est 10 fois supérieure à la solubilité de LiOH. Par conséquent, il est possible de précipiter la plupart des LiOH tout en gardant NaOH et KOH dans la solution.
L’utilisation des technologies de cristallisation fournies par Condorchem Envitech peut aider lors de la production de LiOH.
Solution 6. Production de LiCl
Le chlorure de lithium peut être produit par traitement du carbonate de lithium avec HCl.
Li2CO3 + 2HCI –> 2LiCI + H2CO3
L’utilisation des technologies de cristallisation fournies par Condorchem Envitech peut faciliter le processus de production de LiCl.
Solution 7. Traitement des résidus
Une solution ZLD est visée. Des opportunités de récupération de l’eau et des métaux peuvent être disponibles. Volume d’effluent réduit.
Une combinaison de technologies de traitement de l’eau et des déchets solides est nécessaire.
L’utilisation des technologies de concentration par membrane et par évaporation fournies par Condorchem Envitech peut faciliter une solution ZLD.
Références bibliographiques
[1] O. A. Hougen, K.M. Watson, R. A. Ragatz, Principios de los Procesos Químicos. Parte
II Termodinámica, Editorial Reverté, Madrid, 1964.
[2] O. A. Hougen, K.M. Watson, R. A. Ragatz, Principios de los Procesos Químicos. Parte I
Balances de Materia y Energía, Editorial Reverté, Madrid, 1964.
[3] J. M. Smith, H. C. Van Ness, Introducción a la Termodinámica en Ingeniería Química,
3ª Edición, Editorial McGraw-Hill, 1982.CAP.1. INTRODUCCIÓN 9
[4] Roine, A., HSC Chemistry Software, Versión 5.11, Outokumpu Research Oy,
Información Servie P. O. Box 60 FIN-28101 PORI, Finland, 2005.
[5] L. David, Parkhurst, C. A. J. Appelo, User’s Guide to PHREEQC (version 2), U. S.
Geolical Survey Box 25046, MS 418, Denver, Colorado, 1999.
[6] gPROMS ModelBuilder version 2.3.1, Process Systems Enterprise Limited, 2004.
[7] K. S. Pitzer, J. Phys. Chem., 77(1973) 268-277.
[8] H. Renon, J. M. Prausnitz, AIChe J., 14 (1968) 135-144.
[9] C.F. Weber, Eng. Chem. Data, 39 (2000) 4422-4426.
[10] Y. Li, P. Song, S. Xia, S. Gao, CALPHAD, 24 (2000) 295-308.
[11] F. Farelo, C. Fernandes, A. Avelino, J. Chem. Eng. Data, 50(2005) 1470-1477.
[12] C. Monnin, M. Dubois, N. Papaiconomou, J. P. Simonin, J. Chem. Eng. Data, 47 (2002)
1331-1336.
[13] Chr. Christov, Chr. Balarew, S. Petrenko, Vl. Valyashko, Journal of Solution Chemistry,
23 (1994) 595-604.
[14] Z. Li, T. Deng, M. Liao, Fluid Phase Equilibria, 293 (2010) 42-46.
[15] Chr. Christov, Computer Coupling of Phase Diagrams and Thermochemistry, 36 (2012)
71-81.
[16] D. Zeng, Z. Wu, Y. Yao, H. Han, J. Solution Chem, 39 (2010) 1360-1376.
[17] J. M. Prausnitz, R. N. Lichtenthaler, E. G. Azevedo, Molecular Thermodynamic of
Fluid-Phase Equilibria, Prentice-Hall, Inc, Englewood Cliffs, NJ, 1998.
[18] D. A. Weingaertner, S. Lynn, D. N. Hanson, Ind. Eng. Chem. Res., 30 (1991) 490-501.
[19] T. A. Graber, H. Medina, H. R. Galleguillos, M. E. Taboada, J. Chem. Eng. Data, 52
(2007) 1262-1267.
[20] Y. T. Wu, D. Q. Lin, Z. Q. Zhu, L. H. Mei, Fluid Phase Equilibria, 124 (1996) 67-69.